SỞ GD VÀ ĐT QUẢNG NAM
TRƯỜNG THPT LÊ HỒNG PHONG
--------------------
(Đề thi có 03 trang)
KIỂM TRA HỌC KỲ II NĂM HỌC 2024 - 2025
MÔN: HÓA HỌC 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
Họ và tên: ............................................................................ Số báo danh: ....... Mã đề 301
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi
thí sinh chỉ chọn một phương án.
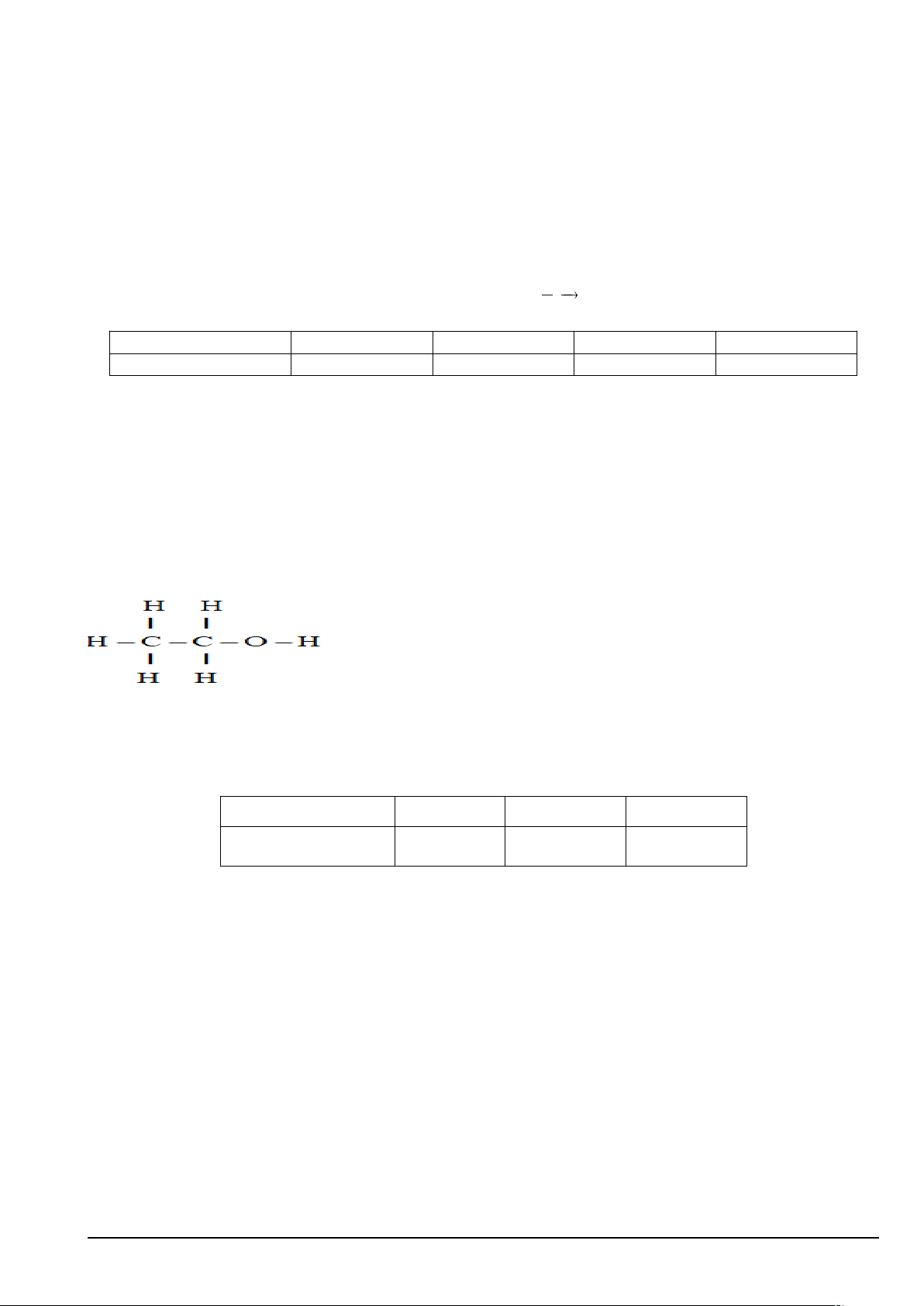
Câu 1. Cho phản ứng xảy ra trong pha khí sau: H2 + Cl2 2HCl. Biểu thức tốc độ trung bình của
phản ứng là:
A. .B. .
C. .D. .
Câu 2. Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
A. Phản ứng một chiều. B. Phản ứng thuận nghịch.
C. Tốc độ phản ứng. D. Cân bằng hóa học.
Câu 3. Thuốc tím chứa ion permanganate (MnO4-) có tính oxi hóa mạnh, được dùng để sát trùng, diệt
khuẩn trong y học, đời sống và nuôi trồng thủy sản. Số oxi hóa của manganse trong ion permangante là
A. +3. B. +7. C. +6. D. +2.
Câu 4. Trong dãy hydrohalic acid: HF, HCl, HBr, HI. Chất có tính acid yếu nhất trong dãy là
A. HF. B. HBr. C. HCl. D. HI.
Câu 5. Ứng dụng nào sau đây không phải của chlorine?
A. Xử lí nước bể bơi. B. Sát trùng vết thương trong y tế.
C. Sản xuất nhựa PVC. D. Tẩy trắng.
Câu 6. Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao vượt trội so với hydrogen
hadile còn lại là do
A. Các nhóm phân tử HF được tạo thành do có liên kết hydrogen giữa các phân tử.
B. Năng lượng liên kết H-F bền vững làm cho HF khó bay hơi.
C. Fluorine là phi kim mạnh nhất.
D. Fluorine có nguyên tử khối nhỏ nhất.
Câu 7. Cho các phương trình nhiệt hoá học sau:
(1) C2H4(g) + H2(g) → C2H6(g) = -137,0kJ.
(2) Fe2O3(s) + 2Al(s) → Al2O3(s) + 2Fe(s) = -851,5kJ.
Nhận xét nào sau đây là đúng?
A. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
B. Cả hai phản ứng đều toả nhiệt.
C. Cả hai phản ứng đều thu nhiệt.
D. Phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
Câu 8. Khi đun nóng, đơn chất halogen nào thăng hoa chuyển từ thể rắn sang thể hơi màu tím là
A. F2.B. Cl2.C. I2.D. Br2.
Câu 9. Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây?
A. Thời gian xảy ra phản ứng.
B. Bề mặt tiếp xúc giữa các chất phản ứng.
C. Chất xúc tác.
D. Nồng độ các chất tham gia phản ứng.
Câu 10. Phương trình nhiệt hoá học sau đây (hình vẽ) ứng với sơ đồ biểu diễn biến thiên enthalpy của
phản ứng sau:
Mã đề 301 Trang 1