
http://www.ebook.edu.vn
Ch1_Cac_khai_niem.doc 1
Ch−¬ng 1. C¸c kh¸i niÖm, tiªn ®Ò
1.1 §iÒu kiÖn ph¶n øng
C©u hái ph¶n øng cã kh¶ n¨ng x¶y ra hay kh«ng lµ ®èi t−îng cña nhiÖt ®éng häc.
Trong phÇn nhiÖt ®éng häc chóng ta ®· lµm quen víi kh¸i niÖm vÒ c¸c d¹ng n¨ng
l−¬ng nh− entalpy-H, entropy-S, n¨ng l−îng tù do Gibbs-G vµ ®iÒu kiÖn ®Ó ph¶n
øng cã thÓ tù x¶y ra.
1.1.1 §iÒu kiÖn nhiÖt ®éng häc
Nguyªn lÝ hai cña nhiÖt ®éng häc cho thÊy ph¶n øng chØ cã thÓ x¶y ra nÕu vÒ mÆt
n¨ng l−îng hÖ ph¶n øng ®¸p øng ®iÒu kiÖn sau:
Δ
G =
Δ
H
−
T
Δ
S < 0 (*)
Ta cã hai tr−êng hîp biªn, hoÆc lµ
Δ
H << 0; hoÆc lµ
Δ
S >> 0, khi ®ã
Δ
G < 0. Nh−
vËy cã thÓ nãi, nÕu ph¶n øng to¶ nhiÖt m¹nh (ΔH << 0), hoÆc t¨ng m¹nh entropy
(ΔS >> 0 nh− ph¶n øng ho¸ h¬i) th× chóng lµ c¸c ph¶n øng th−êng lµ tù diÔn biÕn.
Tr−êng hîp ΔH, ΔS kh«ng qu¸ lín ta cÇn tÝnh ΔG nh− ph−¬ng tr×nh (*) ®· nªu.
Tuy nhiªn, ®iÒu kiÖn nhiÖt ®éng häc lµ cÇn nh−ng ch−a ®ñ. §Ó ph¶n øng x¶y ra ë
møc cã thÓ ghi nhËn ®−îc cÇn ®¸p øng c¶ c¸c ®iÒu kiÖn ®éng häc.
1.1.2 §iÒu kiÖn ®éng häc
Các phản ứng tự diễn biến thường toả nhiệt, dẫn tới giảm năng lượng tự do của hệ
phản ứng. Tuy nhiên, rất nhiều phản ứng, mặc dù ΔH, ΔG rất âm, nhưng tốc độ
phản ứng thực tế rất nhỏ, thậm chí khó ghi nhận được. Ví dụ, phản ứng H2(g) +
(1/2)O2(g) → H2O có nhiệt phản ứng ΔH = − 285 kJ/mol, tuy nhiên trong thực tế
với hỗn hợp phản ứng H2(g) + O2(g) không ghi nhận được sản phẩm phản ứng, trừ
khi hỗn hợp phản ứng được đốt nóng. Đó là vì, mặc dù nhiệt phản ứng lớn nhưng
để bắt đầu phản ứng cần có nguồn năng lượng từ ngoài cấp vào để phá vỡ liên kết
ban đầu của các phân tử chất phản ứng, ở đây là H2 và O2, các phân tử chất phản
ứng không thể tự phá vỡ các liên kết cũ để hình thành các liên kết mới của sản
phẩm. Để hình dung nhu cầu năng lượng cần cấp cho hỗn hợp phản ứng, ta xét
năng lượng liên kết của H2 và O2, chúng bằng khoảng 435 và 490 kJ/mol tương
ứng. Như vậy để phản ứng có thể xảy ra, ngoài các điều kiện nhiệt động học như
đã nêu còn cần đáp ứng các điều kiện động học của phản ứng.
Thø nhÊt, ph¶n øng chØ cã thÓ x¶y ra nÕu cã va ch¹m gi÷a c¸c ph©n tö chÊt ph¶n
øng. §©y lµ xuÊt ph¸t ®iÓm cña ®Þnh luËt t¸c dông khèi l−îng:
W = k. A
n
A
C.B
n
B
C (**)
Để làm rõ khái niệm về va chạm ở mức phân tử, nguyên tử cần quay lại lí thuyết
động lực học phân tử chất khí. Để so sánh trực tiếp tốc độ của các quá trình cơ bản,

http://www.ebook.edu.vn
Ch1_Cac_khai_niem.doc 2
trong đó có va chạm phân tử, có thể sử dụng bảng số liệu sau (A.H. Zewail,
Femtochem.: atomic-scale dynamics of the chemical bond. J. Phys. Chem. A 104, 5660
(2000)):
Quá trình t, ns Nguồn
Phát xạ điện tử từ trạng thái kích thích 1×101 Phần 13.3b (Atkins, 1998)
Chuyển động quay 3×10-2 B ~ 1 cm-1
Dao động phân tử 3×10-5 số sóng t.bình ν ~ 1000 cm-1
Trao đổi proton (trong nước) 2×10-5 Phần 21.7a (Atkins, 1998)
Phản ứng gây ra phản xạ của mắt* 1×10-4 Impact I14.2
Trao đổi năng lượng trong quang hợp** 1×10-3 Impact I23.2
Trao đổi điện tử trong quang hợp 3×10-3 Impact I23.2
Chuyển hoá helix-coil (vòng xoắn) trong polypeptit 2×102 Impact I22.1
Va chạm trong chất lỏng*** 4×10-4 Phần 21.1b (Atkins, 1998)
*Đồng phân hoá retinal từ 11-cis thành tất cả-trans
** Thời gian từ lúc hấp phụ tới khi điện tử chuyển tới pigment (hạt có màu) gần nhất
*** Sử dụng công thức tính cho chất khí ở 300K, các thông số chất lỏng là của benzen, lấy từ
phần Data (Atkins, 1998)
Tần số va chạm chất khí (số va chạm trong 1 giây): tính từ thuyết động lực học chất khí, ở P = 100
kPa (1 bar), T = 300K, dòng va chạm vào tường ZW = 3.1023 cm-2s-1 (Atkins, 1998, pp. 724). Thực
tế, đối với không khí (M = 29), ở 25 oC dòng va chạm = 3.1027 m-2.s-1. Giả thiết bề mặt là kim loại,
với 1 m2 có 1019 nguyên tử, suy ra 1 nguyên tử bề mặt trong 1 giây nhận 108 va chạm.
Tuy nhiªn, kh«ng ph¶i va ch¹m nµo còng dÉn ®Õn ph¶n øng. Sù ph¸t triÓn cña c¸c lÝ
thuyÕt ph¶n øng vµ thùc nghiÖm dÉn ®Õn c¸c kh¸i niÖm va ch¹m ho¹t ®éng, n¨ng
l−îng ho¹t ho¸ E* hay EA, ®iÒu nµy nghÜa lµ kh«ng ph¶i tÊt c¶ c¸c va ch¹m ®Òu dÉn
®Õn ph¶n øng mµ chØ cã mét phÇn nhá trong sè ®ã, c¸c va ch¹m cña c¸c ph©n tö cã
n¨ng l−îng ®ñ lín míi dÉn ®Õn ph¶n øng. §©y lµ ®iÒu kiÖn thø hai.
Ngoµi ra, va ch¹m cÇn ®¸p øng c¸c ®iÒu kiÖn vÒ yÕu tè kh«ng gian. Nh− ®· biÕt,
ph©n tö chÊt ph¶n øng lu«n n»m trong tr¹ng th¸i chuyÓn ®éng nhiÖt v« h−íng, nh−
vËy vÞ trÝ tiÕp xóc khi hai ph©n tö va ch¹m víi nhau hoµn toµn mang tÝnh ngÉu
nhiªn. Víi c¸c ph©n tö lín, cã cÊu tróc phøc t¹p ph¶n øng chØ cã thÓ x¶y ra nÕu va
ch¹m ®−îc thùc hiÖn vµo vÞ trÝ c¸c liªn kÕt sÏ ph¶n øng. HiÓn nhiªn lµ x¸c suÊt ®Ó
va tr¹m “tróng ®Ých” nh− vËy lµ rÊt nhá. Ba néi dung võa nªu lµ c¸c ®iÒu kiÖn ®éng
häc cña ph¶n øng, ®ång thêi lµ néi dung cña thuyÕt va ch¹m ho¹t ®éng (Ch−¬ng 3).
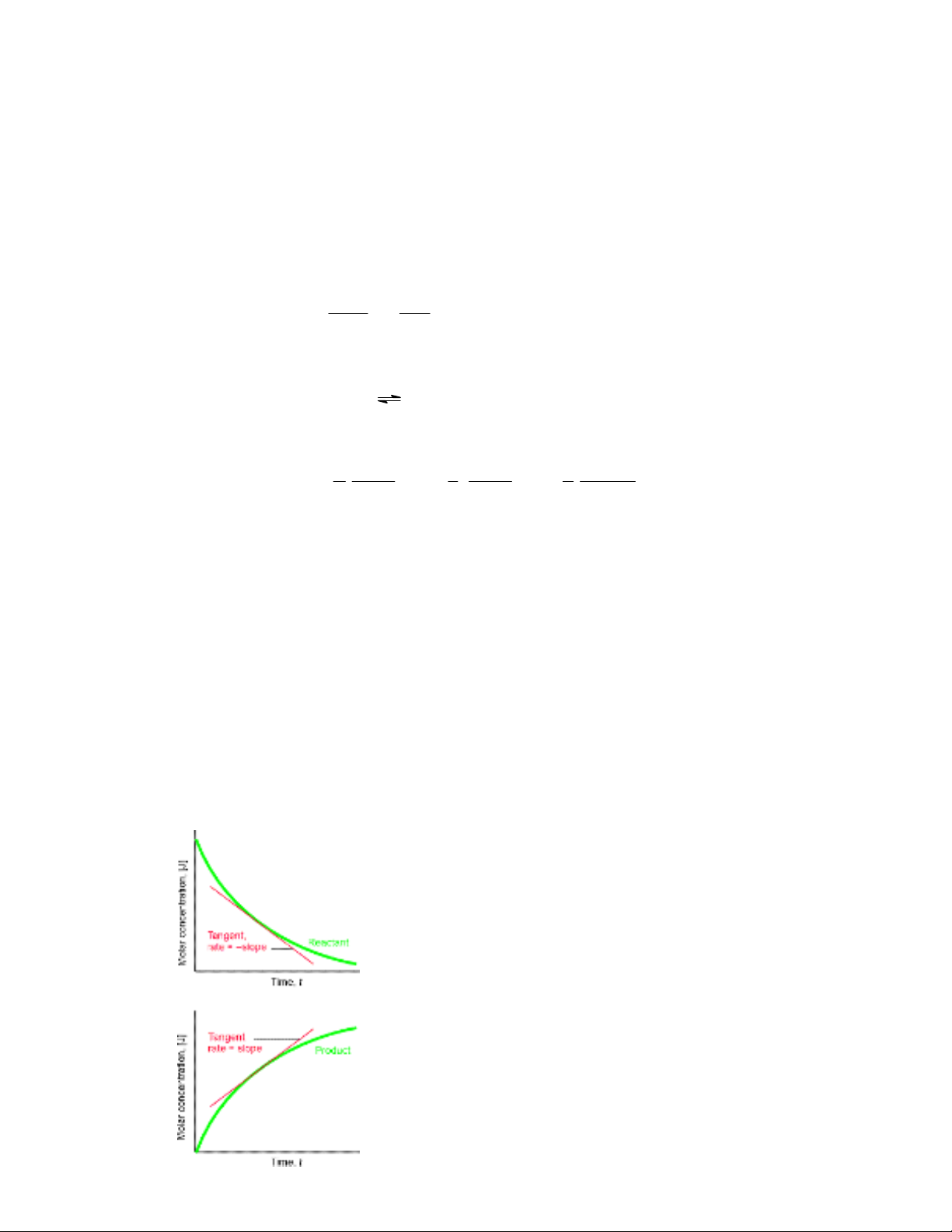
1.2 §−êng cong ®éng häc vµ kh¸i niÖm tèc ®é ph¶n øng
Khi xÐt mét ph¶n øng, vÝ dô ®¬n gi¶n nhÊt lµ chÊt A ph¶n øng t¹o chÊt B, ta viÕt:
A → B
Gi¶ sö ph¶n øng ®−îc tiÕn hµnh trong b×nh kÝn, ®−îc khuÊy trén tèt, ë ®iÒu kiÖn
nhiÖt ®é æn ®Þnh. Theo thêi gian ta lÊy mÉu vµ ph©n tÝch ®Þnh l−îng CA vµ CB. Khi
®ã, theo thêi gian ph¶n øng t, CA gi¶m dÇn, CB t¨ng dÇn. NÕu biÓu diÔn C theo t ta
cã ®−êng cong ®éng häc (H×nh 1.1).
Tõ ®©y ta cã c¸c kh¸i niÖm tèc ®é chuyÓn ho¸ chÊt i vµ tèc ®é ph¶n øng:

http://www.ebook.edu.vn
Ch1_Cac_khai_niem.doc 3
H×nh 1.1- §−êng cong ®éng häc hay diÔn biÕn C theo t trong tr−êng hîp ph¶n øng A
→
B
Cã thÓ h×nh dung vËn tèc ë ®©y t−¬ng tù nh− kh¸i niÖm vËn tèc trong chuyÓn ®éng
c¬ häc víi vËn tèc trung b×nh v =
Δ
L/
Δ
t hay vËn tèc tøc thêi v = dL/dt.
Với phản ứng hoá học ta có định nghĩa:
Tốc độ chuyển hoá chất i, Wi:
tV
ni
iΔ
Δ
±=W
Kí hiệu W là vận tốc trung bình.
Trong đó:
Δ
ni là biến thiên số mol chất i trong thể tích phản ứng V trong khoảng
thời gian
Δ
t.
Lưu ý
Δ
n/V =
Δ
C ta có:
t
Ci
iΔ
Δ
±=W
Như vậy đơn vị của tốc độ [W] = M.t-1.
Thay dấu Δ trong biểu thức (1.1) bằng dấu vi phân ta có:
dt
dC
Vdt
dn ii ±=±=
i
W (1.1)
§iÓm kh¸c biÖt so víi tèc ®é chuyÓn ®éng c¬ häc lµ ë ®©y cã dÊu (±), dÊu céng lµ
chØ nång ®é s¶n phÈm vµ dÊu (−) lµ chØ nång ®é chÊt ph¶n øng, vµ nhÊt lµ kh¸c ë
®¬n vÞ, th−êng W cã ®¬n vÞ lµ (mol L-1 t-1), t cã thÓ lµ s, min, h, ngµy, n¨m tuú tèc
®é ph¶n øng nhanh hay chËm.
Vậy, bằng lời ta có thể phát biểu: vận tốc chuyển hoá chất i, Wi, là số phân tử chất
i tham gia phản ứng (i là chất phản ứng), hoặc số phân tử sản phẩm hình thành (i
là sản phẩm) trong một đơn vị thể tích và một đơn vị thời gian.
Víi ph¶n øng:
ν
AA +
ν
BB
→
ν
SPSP
Theo ®Þnh nghÜa (1.1) ta cã:
Tèc ®é chuyÓn ho¸ chÊt A: WA =
−
dCA/dt
Tèc ®é chuyÓn ho¸ chÊt B: WB =
−
dCB/dt
C
t
ChÊt ph¶n øng
S¶n
p
hÈm
http://www.ebook.edu.vn
Ch1_Cac_khai_niem.doc 4
Tèc ®é t¹o s¶n phÈm SP: WSP = + dCSP/dt
Tèc ®é ph¶n øng:
Theo biÓu thøc ®Þnh nghÜa (1.1) ta thÊy víi c¸c ph¶n øng cã hÖ sè tû l−îng kh¸c 1
th× tèc ®é chuyÓn ho¸ cña c¸c thµnh phÇn trong hÖ kh«ng b»ng nhau, ®Ó biÓu diÔn
tèc ®é ph¶n øng b»ng mét biÓu thøc ®¬n gi¸ cÇn bæ xung thªm hÖ sè c©n b»ng
ν
i,
khi ®ã ph−¬ng tr×nh (1.1) cã d¹ng:
dt
dC
Vdt
dn
i
i
i
i
νν
±=±=W (1.1’)
Ta thÊy râ ®iÒu nµy qua vÝ dô ph¶n øng:
1N2 + 3H2 2NH3
Theo ®Þnh nghÜa (1.1’) ta cã:
W =
−
1
1
dt
]N[d 2 =
−
3
1 dt
]H[d 2 = + 2
1
dt
]NH[d 2
Nh− vËy, biÓu thøc (1.1) thùc chÊt lµ tèc ®é chuyÓn ho¸ mét chÊt cô thÓ; nÕu tÝnh
tíi hÖ sè tû l−îng
ν
th× khi tÝnh vËn tèc ph¶n øng theo chÊt nµo th× cÇn chia vËn tèc
chuyÓn ho¸ chÊt Êy cho hÖ sè
ν
cña nã.
Tóm lại, chỉ khi
ν
= 1 thì tốc độ phản ứng mới bằng tốc độ chuyển hoá, trường hợp
ν
> 1 để tính vận tốc phản ứng cần áp dụng biểu thức (1.1’).
Từ đường cong động học có thể xác định được vận tốc phản ứng ở bất kì thời điểm
nào. Để thực hiện điều này, theo định nghĩa (1.1) dC/dt chính là độ dốc của tiếp
tuyến với đường cong động học ở giá trị t đã định, như vậy ở t cần kẻ đường tiếp
tuyến với đường cong động học như hình 1.2 là ta xác định được vận tốc chuyển
hoá hoặc vận tốc phản ứng W ở bất kì thời điểm nào.
Hình 1.2- Xác đ
ị
nh tốc độ t
ứ
c th
ờ
i

http://www.ebook.edu.vn
Ch1_Cac_khai_niem.doc 5
§Þnh luËt t¸c dông khèi l−îng vµ ®Þnh luËt tèc ®é ph¶n øng hay ph−¬ng tr×nh tèc
®é ph¶n øng:
Víi ph¶n øng: aA + bB → SP
ta cã ®Þnh luËt t¸c dông khèi l−îng (Guldberg C., Waaga P., 1867):
W = kCAaCBb
Trong thùc tÕ:
W = kCAnACBnB (
1.2)
trong ®ã: k- h»ng sè vËn tèc ph¶n øng
n
A, nB lµ bËc cña ph¶n øng theo chÊt A, B t−¬ng øng
n = nA + nB lµ bËc chung cña ph¶n øng
Ví dụ 1.1 Tốc độ chuyển hoá và tốc độ phản ứng
Nếu tốc độ hình thành NO trong phản ứng 2NOBr(g) → 2NO(g) + Br2(g) bằng
1,6 x 10-4 molL-1s-1, với νNO = +2 ta có tốc độ phản ứng W = -(1/2)d[NOBr]/dt =
(1/2) x 1,6 x 10-4 molL-1s-1 = 8,0 x 10-5 molL-1s-1.
Tương tự tốc độ phân huỷ NOBr là d[NOBr]/dt = 1,6 x 10-4 molL-1s-1.
1.3 C¸c kh¸i niÖm k, n, m vµ ph©n lo¹i ph¶n øng
Nh− vËy tõ ph−¬ng tr×nh (1.2) ta thÊy:
k lµ hÖ sè tû lÖ, nã b»ng W khi C = 1, v× vËy ®«i khi ta gäi k lµ vËn tèc riªng. §©y
lµ th−íc ®o tèc ®é ph¶n øng ë ®iÒu kiÖn quy chuÈn lµ C = 1.
n lµ sè mò cña ®¹i l−îng nång ®é trong ph−¬ng tr×nh tèc ®é (1.2), ®−îc x¸c ®Þnh
b»ng thùc nghiÖm vµ ®−îc gäi lµ bËc ph¶n øng; nA lµ bËc ph¶n øng theo chÊt A; nB
lµ bËc ph¶n øng theo chÊt B; tæng nA + nB = n lµ bËc chung cña ph¶n øng.
Ngoµi ra ta cã kh¸i niÖm m- ph©n tö sè lµ sè ph©n tö khi va ch¹m ®ång thêi g©y ra
ph¶n øng. Nh− vËy m chØ cã thÓ lµ 1, 2, 3. Khi ®ã ta gäi lµ ph¶n øng ®¬n ph©n tö,
l−ìng vµ tam ph©n tö. Kh¸i niÖm m chØ ¸p dông cho tr−êng hîp ph¶n øng mét giai
®o¹n hay ph¶n øng c¬ b¶n.
Để tiện cho tính toán (xem Chương 2) người ta phân loại phản ứng theo bậc n, như
vậy ta có các phản ứng bậc n = 0, = 1, = 2, = 3 và = n.
1.3.1 Ph¶n øng c¬ b¶n
Nh÷ng ph¶n øng mét giai ®o¹n (nghÜa lµ A, B sau mét va ch¹m dÉn ®Õn s¶n phÈm)
®−îc gäi lµ ph¶n øng c¬ b¶n, vÝ dô:
H
• + Br2 → HBr + Br•
CH3−O−CH3 → CH4 + CO + H2
(Xem thªm Ch−¬ng 3, 4).



![Đề cương môn học Chuyển đổi Nhiệt động lực học [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2020/20200302/covid19/135x160/7991583168321.jpg)






















