
Table of Contents
GIẢI ĐÁP BTTN HĐC CHƯƠNG 02 – CẤU TẠO NGUYÊN TỬ2
GIẢI ĐÁP BTTN HĐC CHƯƠNG 03 – BẢNG HTTH 3
GIẢI ĐÁP BTTN HĐC CHƯƠNG 04 - LKHH 6
GIẢI ĐÁP BTTN HĐC CHƯƠNG 06 – NHIỆT HÓA HỌC12
GIẢI ĐÁP BTTN HĐC CHƯƠNG 07 – THẾ ĐẲNG ÁP ĐẲNG NHIỆT18
GIẢI ĐÁP BTTN HĐC CHƯƠNG 08 - CÂN BẰNG HÓA HỌC20
GIẢI ĐÁP BTTN HĐC CHƯƠNG 10 – ĐỘNG HÓA HỌC25
GIẢI ĐÁP BTTN HĐC CHƯƠNG 11 – DUNG DỊCH PHÂN TỬ27
GIẢI ĐÁP BTTN HĐC CHƯƠNG 12 – DUNG DỊCH ĐIỆN LY 30
GIẢI ĐÁP BTTN HĐC CHƯƠNG 14 - CÂN BẰNG TRONG DUNG DỊCH CHẤT ĐIỆN LY
KHÓ TAN 34
GIẢI ĐÁP BTTN HĐC CHƯƠNG 16 – ĐIỆN HÓA HỌC37
GIẢI BÀI TẬP TRẮC NGHIỆM HÓA ĐẠI CƯƠNG

GIẢI ĐÁP BTTN HĐC CHƯƠNG 02 – CẤU TẠO NGUYÊN TỬ
2.10 Nguyên tố Clo có hai đồng vị bền là
Cl
35
17
và
Cl
37
17
.Tính tỉ lệ % hiện diện của đồng vị
Cl
35
17
,
biết khối lượng nguyên tử trung bình của Cl là 35,5.
a) 25% b) 75% c) 57% d) 50%
Giải: Đặt tỉ lệ % hiện diện của
Cl
35
17
là α thì của
Cl
37
17
là (100-α).
Ta có: 𝐴𝐶𝑙 = 35α + 37(100-α) = 35.5.
α = 75% (ĐA b)
2.32 Cho biết giá trị của số lượng tử chính n và số electron tối đa của lớp lượng tử O và Q?
Công thức tính số e tối đa ở lớp thứ n bằng 2n2 (ĐA b)
2.36 Electron cuối cùng của nguyên tử 15P có bộ 4 số lượng tử là (qui ước electron phân bố vào
các orbitan trong phân lớp theo thứ tự mℓ từ -ℓ đến +ℓ):
15P: 3s2 3p3: Phân lớp cuối cùng là 3p3:
↑
↑
↑
mℓ = -1 0 +1
=> e cuối cùng (màu đỏ) có 4 số lượng tử: n = 3; ℓ = 1; mℓ = +1; ms = +½. (ĐA b)
2.37 Electron ngoài cùng của nguyên tử 30Zn có bộ 4 số lượng tử là (qui ước electron phân bố
vào các orbitan trong phân lớp theo thứ tự mℓ từ -ℓ đến +ℓ):
30Zn: 4s2 3d10: Phân lớp ngoài cùng là 4s2: ↑↓
=> e ngoài cùng (cả 2 e màu đỏ) có 4 số lượng tử: n = 4; ℓ = 0; mℓ = 0; ms = ±½. (ĐA a)
2.38 Nguyên tử Cs có năng lượng ion hóa thứ nhất nhỏ nhất trong bảng hệ thống tuần hoàn là
375.7 kJ/mol. Tính bước sóng dài nhất của bức xạ có thể ion hóa được nguyên tử Cs thành
ion Cs+. Bức xạ này nằm trong vùng nào của quang phổ điện từ? (Cho h = 6.626 × 10-34 J.s
và c = 3 ×108 ms-1)
∆𝐸 = ℎ𝑐
𝜆 => 𝜆 = ℎ𝑐
∆𝐸 =6.626×10−34𝐽.𝑠 ×3×108𝑚.𝑠−1×6.022×1023𝑒×𝑚𝑜𝑙−1
375.7×103𝐽= 318.6 × 10−9𝑚
=> λ = 318.6 nm, tử ngoại. (ĐA c)
2.39 Ion X4+ có cấu hình e phân lớp cuối cùng là 3p6. Vậy giá trị của 4 số lượng tử của e cuối
cùng của nguyên tử X là ( qui ước mℓ có giá trị từ -ℓ đến +ℓ)
X4+: 3p6 => X: 4s2 3d2 => Phân lớp cuối cùng là 3d2.
↑
↑
mℓ = -2 -1 0 +1 +2
=> e cuối cùng (màu đỏ) có 4 số lượng tử: n = 3; ℓ = 2; mℓ = -1; ms = +½. (ĐA b)
2.40 Nguyên tố nào trong chu kỳ 4 có tổng spin trong nguyên tử bằng +3 theo qui tắc Hund?
Σms = +3 => Số e độc thân =+3
+½ = 6 (Vì mỗi e độc thân có số lượng tử spin ms = +½)
Trong chu kỳ 4 cấu hình e hóa trị thích hợp đủ chứa 6e độc thân duy nhất chỉ là:
24Cr: 4s1 3d5 (ĐA a)

GIẢI ĐÁP BTTN HĐC CHƯƠNG 03 – BẢNG HTTH
3.5 Trong chu kỳ 4, nguyên tố nào ở trạng thái cơ bản có 3 electron độc thân? Cho: 23V; 24Cr;
25Mn: 26Fe; 27Co; 28Ni; 32Ge; 33As; 34Se; 35Br.
Giải: Viết các phân lớp bắt đầu và kết thúc nhận e thuộc chu kỳ 4, sau đó tìm cấu hình e
thích hợp có chứa 3 e độc thân.
*4s1-2 (không có)
*4s2 3d1-10: có 2 cấu hình có chứa 3e độc thân:
23V: 4s2 3d3.
27Co: 4s2 3d7.
*Và 4s2 3d10 4p3 là 33As. (ĐA c)
3.12 Dựa trên quy tắc xây dựng bảng HTTH, dự đoán điện tích hạt nhân của nguyên tố kim loại
kiềm (chưa phát hiện) ở chu kỳ 8. Biết 87Fr là nguyên tố kim loại kiềm thuộc chu kỳ 7.
Giải: Có 2 cách làm:
*Cách 1: 87Fr ở đầu CK7. Vậy ta phải đi qua hết số nguyên tố có ở CK7 (là 32) mới xuống
đến nguyên tố KL kiềm ở đầu CK8. Nên điện tích hạt nhân của nguyên tố KL kiềm này là
87+32 = 119.
*Cách 2: Nguyên tố cuối cùng hiện nay của CK7 (cũng là cuối cùng của BHTTH) là khí trơ
có điện tích hạt nhân = 118. Vậy nguyên tố tiếp theo là nguyên tố KL kiềm ở đầu CK8 nên
sẽ có điện tích hạt nhân = 118+1 = 119. (ĐA a)
֎Lưu ý: Số nguyên tố có ở mỗi CK là tương ứng với số e cần thiết để lắp đầy các phân lớp:
s2 p6 d10 f14 g18
CK1: 2
CK2&3: 8,8
CK4&5: 18,18
CK6&7: 32,32 118
CK8: 50 168
3.14 Ion X2+ có phân lớp e cuối cùng là 3d5. Hỏi nguyên tử X có electron cuối cùng có bộ 4 số
lượng tử là gì? (Qui ước mℓ từ -ℓ đến +ℓ)
Giải: X2+: 3d5 => X: 4s2 3d5. Phân lớp cuối cùng vẫn là 3d5.
↑
↑
↑
↑
↑
mℓ = -2 -1 0 +1 +2
=> e cuối cùng ( màu đỏ) có 4 số lượng tử: n =3, ℓ =2, mℓ =+2, ms =+½. (ĐA d)
3.18 Chọn phương án không chính xác:
Các nguyên tố có cấu hình electron phân lớp ngoài cùng ns1:
1) chỉ là kim loại. 3) là nguyên tố họ s.
2) chỉ có số oxy hóa +1. 4) chỉ có 1 e hóa trị.
Giải: Các nguyên tố có cấu hình e phân lớp ngoài cùng ns1 gồm:
H: 1s1 (phi kim; họ s; soh = 0, +1, -1)
KL kiềm IA: ns1 (họ s; soh = +1)
KL PN IB: ns1 (n-1)d10 (họ d; soh = +1, +3: Au; số e hóa trị = 11)
KL PN VIB: ns1 (n-1)d5 (họ d; soh = +2,+3,+6; số e hóa trị = 6)
(ĐA d)
3.21 Tính năng lượng ion hóa (eV) để tách electron trong nguyên tử Hydro ở mức n=3 ra xa vô
cùng:
Giải: I = E∞ - E3 = 0 – (−13.6 𝑍2
𝑛2) = 13.6 12
32= 1.51(𝑒𝑉) (ĐA a)
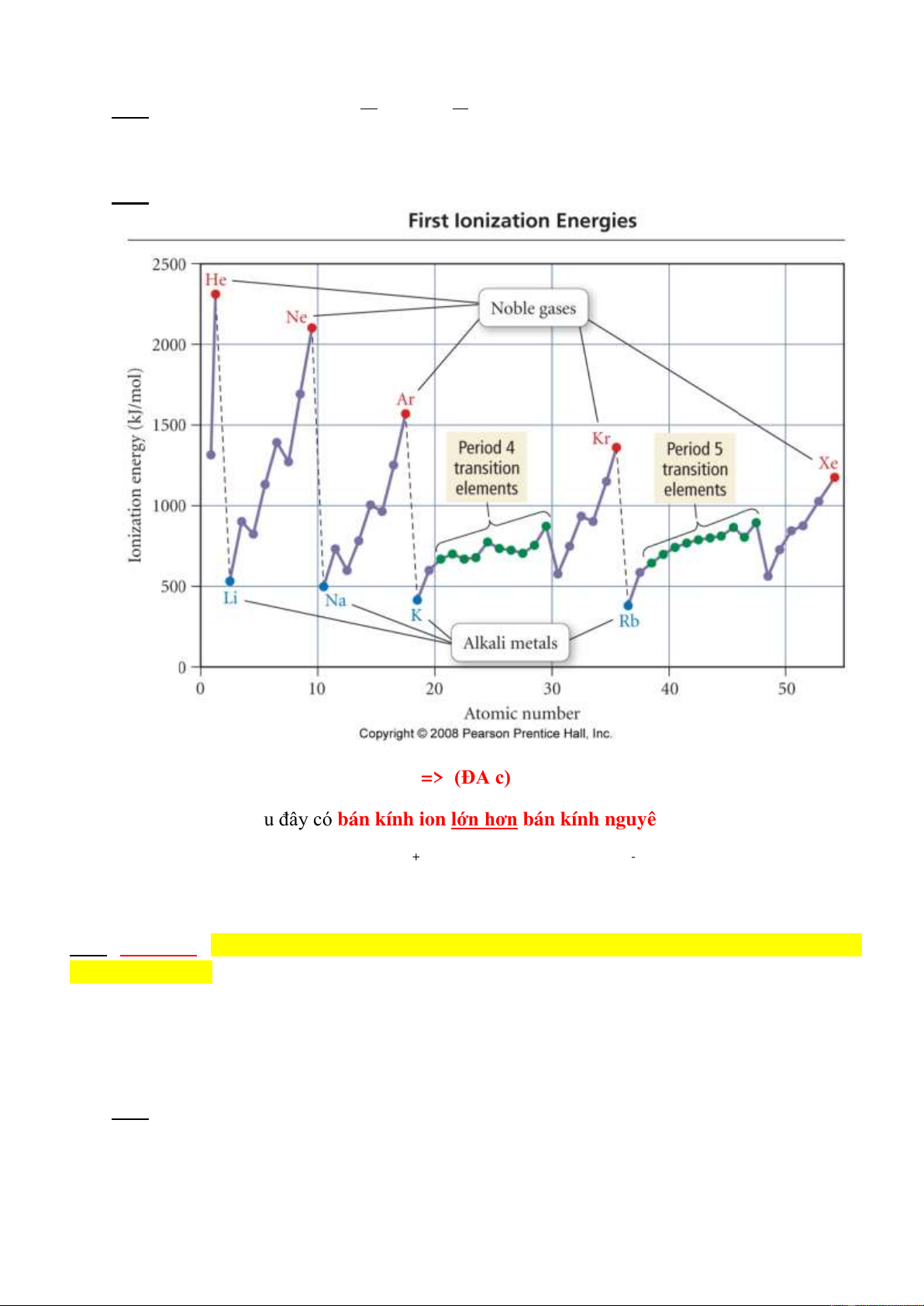
3.25 Cho các nguyên tố chu kỳ 3: 11Na; 12Mg; 13Al; 15P ; 16S. Sắp xếp theo thứ tự năng lượng ion
hóa I1 tăng dần:
Giải: Xem giản đồ biểu diễn I1:
=> (ĐA c)
3.26 Trường hợp nào sau đây có bán kính ion lớn hơn bán kính nguyên tử:
1) Cs và Cs+ 2) 37Rb+ và 36Kr 3) 17Cl- và 18Ar
4) 12Mg và 13Al3+ 5) 8O2- và 9F 6) 37Rb và 38Sr+
Giải: Quy luật: Z càng lớn và tổng số e càng nhỏ thì lực hút của hạt nhân càng mạnh, bán
kính sẽ càng nhỏ
=> (ĐA a. 3,5)
3.32 Chọn câu đúng: Cho các nguyên tố ở chu kỳ 2: 3Li, 4Be, 5B, 6C, 7N, 8O, 9F và 10Ne. Chọn
các nguyên tố có năng lượng ion hóa I1 lớn nhất, I2 lớn nhất (theo thứ tự)
Giải: Xem giản đồ biểu diễn I1 (đường màu đỏ) và I2 (đường màu xanh) của CK2 (nền xanh)
Giải thích:
*I1 lớn nhất ứng với cấu hình nguyên tử bão hòa của khí trơ: Ne.
*I2 lớn nhất ứng với cấu hình cation X+ bão hòa của khí trơ: Li+.
=> (ĐA d)
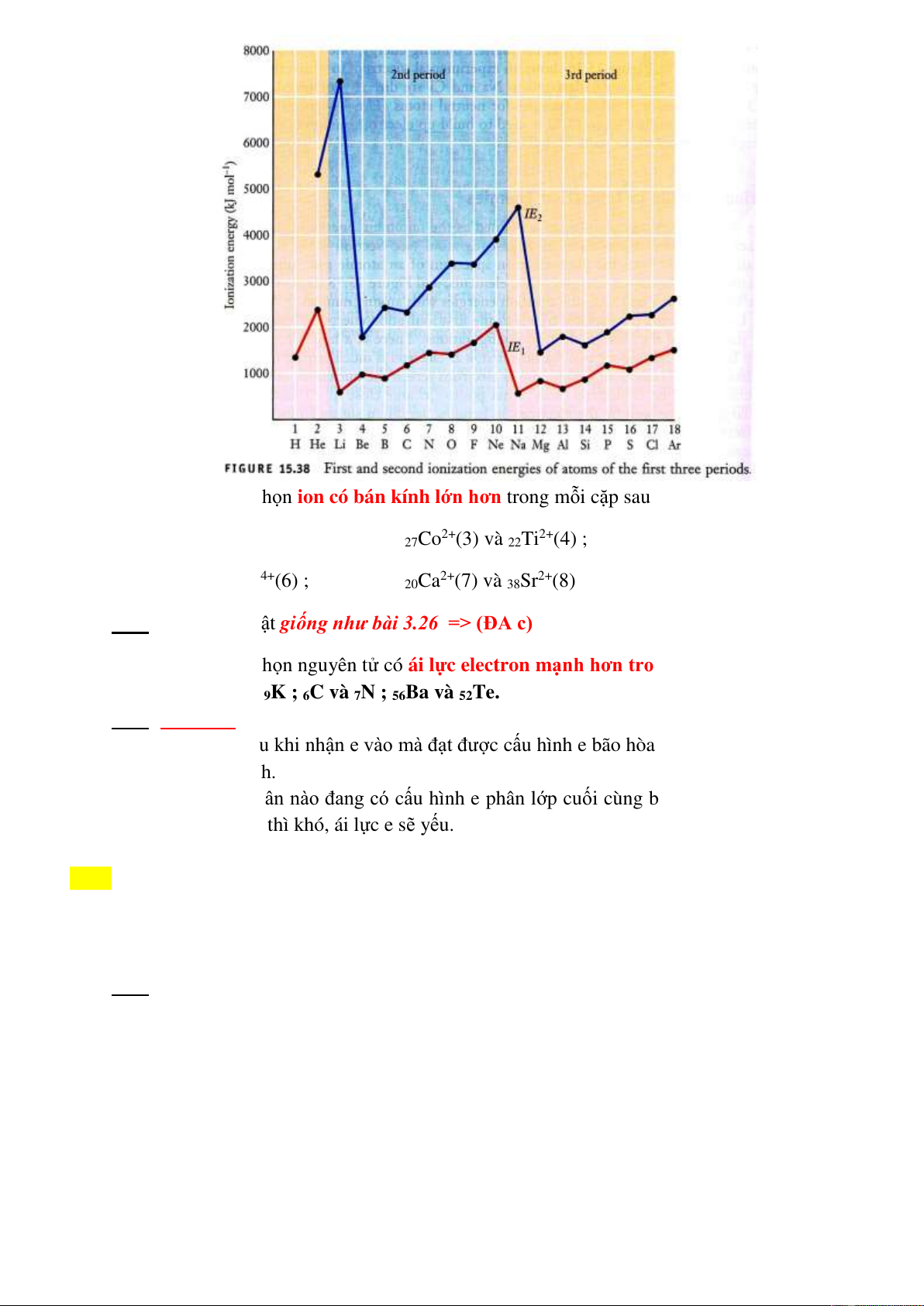
3.33 Chọn câu đúng: Chọn ion có bán kính lớn hơn trong mỗi cặp sau đây:
8O-(1) và 16S2-(2); 27Co2+(3) và 22Ti2+(4) ;
25Mn2+(5) và 25Mn4+(6) ; 20Ca2+(7) và 38Sr2+(8)
Giải: Dùng quy luật giống như bài 3.26 => (ĐA c)
3.34 Chọn câu đúng: Chọn nguyên tử có ái lực electron mạnh hơn trong mỗi cặp sau đây: 54Xe
và 55Cs ; 20Ca và 19K ; 6C và 7N ; 56Ba và 52Te.
Giải: Quy luật:
*Tiểu phân nào sau khi nhận e vào mà đạt được cấu hình e bão hòa hoặc bán bão hòa bền thì
dễ, ái lực e sẽ mạnh.
*Ngược lại tiểu phân nào đang có cấu hình e phân lớp cuối cùng bão hòa hoặc bán bão hòa
bền mà nhận e vào thì khó, ái lực e sẽ yếu.
=> (ĐA a)
3.35 Chọn câu đúng: Tính thuận từ (có từ tính riêng) của các nguyên tử và ion được giải thích là
do có chứa electron độc thân, càng nhiều electron độc thân thì từ tính càng mạnh. Trên cơ sở
đó hãy chọn trong mỗi cặp hợp chất ion sau, hợp chất ion nào bị nam châm hút mạnh nhất?
(Cho Z của Cℓ, Ti, Fe lần lượt là 17, 22, 26) (TiCℓ2 và TiCℓ4) ; (FeCℓ2 và FeCℓ3)
Giải:
*22Ti: 3p6 4s2 3d2 => 22Ti2+: 3d2 có 2 e độc thân. Thuận từ.
=> 22Ti4+: 3p6 không có e độc thân. Nghịch từ.
*26Fe: 4s2 3d6 => 26Fe2+: 3d6 có 4 e độc thân. Thuận từ ít.
=> 26Fe3+: 3d5 có 5e độc thân. Thuận từ nhiều hơn Fe2+.






![Bài tập trắc nghiệm Hóa đại cương [kèm đáp án chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250811/nganga_01/135x160/40711754905793.jpg)
![96 câu trắc nghiệm Đại cương kim loại [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2021/20211006/thtm2728/135x160/2651633457716.jpg)



![Bài tập Vật lý sóng: Tổng hợp bài tập 6 [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250805/oursky04/135x160/401768817575.jpg)














