
Bài 43 : ANKIN
I. MỤC TIÊU :
1. Kiến thức :
Hs biết :
-Khái niệm đồng đẳng , đồng phân , biết tính chất vật lý, danh pháp và cấu trúc phân tử
của ankin
-Phương pháp điều chế và ứng dụng của axetilen
Hs hiểu :
Sự giống nhau và khác nhau về tính chất hoá học giữa ankin và anken .
2. Kỹ năng :
-Viết công thức cấu tạo và gọi tên các hidrocacbon mạch hở
-Phân biệt ank-1-in với anken bàng phương pháp hoá học
-Dự đoán tính chất hoá học
-Viết phương trình phản ứng minh hoạ tính chất của ankin
-Giải tích hiện hượng thí nghiệm .
3. Thái độ:
-Nhận thức được acetylen trong công nghiệp tổng hợp hữu cơ
II. CHUẨN BỊ :
-Hệ thống câu hỏi hình vẽ 6.9và 6.10 (SGK).
-Tranh vẽ hoặc mô hình rỗng , mô hình đặc của phân tử axetilen .
-Dụng cụ : Ong nghiệm , nút cao su kèm ống dẫn khí , cặp ống nghiệm , đèn cồn , bộ giá
ống nghiệm .
-Hoá chất : CaC2 , dd KmnO4 , dd Br2
III.Hoạt động dạy và học:
1.Ổn định lớp:
2Kiểm tra:
Nêu khái niệm , viết một số CTCT của tecpen .
3. Bài mới :
Hoạt động của thầy Hoạt động của trò Nội dung
Hoạt động 1 : vào bài
- Viết tất cả đồng phân của
C3H4 ?
?So với ankanvà anken có gì
khác.
Ngoài ankađien còn có
đồng phân chứa một liên kết
ba trong phân tử .
Hoạt động 2 :
-Gv cho biết một số ankin
tiêu biểu : C2H2 , C3H4
? Viết các đồng phân của
ankin ứng với CTPT:C4H6,
C5H8 ?
- Có liên kết 3 trong phân
tử
- Hs lập thành dãy đồng
đẳng của ankin .
-Hs rút ra nhận xét
- Hs viết các đồng phân
C4H6:
CH3-CH2-CH2CH
I. ĐỒNG ĐẲNG , ĐỒNG
PHÂN , DANH PHÁP VÀ
CẤU TRÚC :
1.Đồng đẳng , đồng phân ,
danh pháp :
-Ankin là những
hiđrôcacbon mạch hở có một
liên kết ba trong phân tử .
-Dãy đồng đẳng của axetilen
có công thức chung là
CnH2n-2
( n≥2 )
Ví dụ :
HC CH , CH3-C

- Gv hướng dẫn Hs gọi tên
theo danh pháp IUPAC và
danh pháp thông thường .
Hoạt động 3 :
Gv giới thiệu cấu trúc
electron qua tranh vẽ hoặc
mô hình của phân tử axetilen
.
? Hướng dẫn cách đọc tên
phân tử khó
?Rút ra quy tắc gọi tên
Hoạt động 4: Hướng dẫn
học sinh quan sát bang
6.2(SGK).
? Nhận xét
Ts0,Tonc,D(g/cm)
Hoạt động 5: Cho HS
quan sát hình 6.9(SGK)
- Gv định nghĩa lại liên
kết:
và liên kết .
Hoạt động 6 :
?Dựa vào cấu tạo phân tử
của ankin háy dự đoán tính
chất hoá học của ankin
- Gv hướng dẫn hs viết
những ptpư khó
- Gv lưu ý Hs phản ứng
cộng HX , H2O vào ankin
cũng tuân theo quy tắc
Maccôpnhicôp .
CH3-CC-CH3
C5H8:
CH C – CH2 – CH2 –
CH3
CH3 – C C – CH2 – CH3
CH C – CH – CH3
CH3
-Hs rút ra quy tắc gọi tên :
tương tự gọi tên anken ,
thay đuôi en thành đuôi in
.
-Quan sát bảng:6.2(SGK)
Ts0,Tonc,D(g/cm) tăng do
khối lượng phân tử tăn
- Hs xem mô hình hoặc
tranh vẽ cấu tạo phân tử
axetinlen .
Hs nhận xét
- Hs quan sát hiện tượng
và nhận xét : màu của dd
Br2 , dd KMnO4 sau phản
ứng
Vì ankin có liên kết
giống anken nên có phản
ứng cộng ,oxi hoá
- Hs viết ptpư :
* Axetilen + H2
* Axetilen + Br2
* Axetilen + HCl
* Axetilen + H2O
* Propin + H2O
CH
-Từ C4 trở đi có đồng phân
vị trí nhóm chức , từ C5 trở
đi có thêm đồng phân mạch
cacbon .
- Danh pháp :
- Tên thông thường :
Gốc ankyl + axetilen
Số chỉ nhánh – tên nhánh –
tên mạch chính – số chỉ liên
kết ba – in
2.Cấu trúc phân tử :
- Trong phân tử ankin , hai
nguyên tử C ở trạng thái lai
hoá sp
- Gồm một lk
và 2 lk .
II. TÍNH CHẤT HOÁ
HỌC :
1.Phản ứng cộng :
a) cộng hiđrô:
HC CH + 2H2 ,o
Ni t
CH3-
CH3
HC CH +H2 3
/Pd PbCO
CH2 =
CH2
b) Cộng brôm :
C2H5 – C C – C2H5
2
20o
Br
C2H5 – C=C – C2H5
Br Br
2
Br
C2H5 – C – C – C2H5
Br Br
c) Cộng nước ( hiđrat hoá )
HC CH + H – OH
-Từ đặc điểm cấu tạo phân
tử ankin , Gv hướng dẫn
HS viết ptpư đime và
trime hoá .
Hoạt động 7 :
-Gv phân tích vị trí
nguyên tử hiđrô ở liên kết
ba của ankin
-làm thí nghiệm C2H2 +
AgNO3 /NH3
Phản ứng này dùng để
nhận biết các ankin có lk
ở đầu mạch .
-Viết ptpư cháy của C2H2
Cho Hs viết ptpư tổng
quát .
Hoạt động 8 :
Gv yêu cầu Hs viết các
ptpư điều chế C2H2 từ
CaCO3 và C
- Gv nêu phương pháp
chính điều chế axetilen
trong CN hiện nay là nhiệt
phân CH4 ở 1500°C
- Hs viết phương trình
phản ứng .
- Hs viết phương trình
phản ứng .
-Hs viết ptpư cháy của
ankin bằng CTTQ
-Nhận xét tỉ lế số mol của
CO2 và H2O .
-Trên cơ sở hiện tượng
quan sát được ở thí
nghiệm trên Hs khẳng
định ankin có phản ứng
oxi hoá với KMnO4 .
- Viết ptpư điều chế C2H2
- Tìm hiểu ứng dụng của
C2H2 trong sgk .
4 2 4
,
80o
HgSO H SO
[CH2=CH –
OH ]
CH3 – CH = O
- Phản ứng cộng HX , H2O
vào các ankin trong dãy
đồng đẳng của axetilen cũng
tuân theo quy tắc
Maccopnhicop .
d) Phản ứng đime hoá và
trime hoá :
-Ankin không trùng hợp
thành polime :
- Đime hoá :
2CH CH
,o
xt t
CH2 = CH – C
CH
-Trime hoá :
3CH CH ,o
xt t
C6H6
2. Phản ứng thế bằng ion
kim loại :
AgNO3 + 3NH3 + H2O
[Ag(NH3)2]+OH- + NH4NO3
HC CH + 2[Ag(NH3)2]OH
Ag – C C – Ag + 2H2O +
4NH3
Phản ứng này dùng để nhận
biết các ankin có lk ba ở đầu
dãy .
3. Phản ứng oxi hoá :
CnH2n-2 +
3 1
2
n
O2
nCO2 + (n-1) H2O
H<0
-Ankin cũng làm mất màu
dd KMnO4
III. ĐIỀU CHẾ VÀ ỨNG
DỤNG :
1. Điều chế :
-Nhiệt phân CH4 :
2CH4 1500o
CH CH +
3H2
-Từ canxicacbua :

CaC2 + 2H2O Ca(OH)2 +
C2H2
2. Ưng dụng :
C2H2 +
5
2
O2 2CO2 +
H2O
H = -
1300KJ
IV.Củng cố:
1.Bài tập hoàn thành sơ đồ phản ứng sau CaC2 C2H2
3
/Pd PbCO
C2H4CH3CH2Br
- Bài 4 .a (SGK)
2.Dặn dò:Các bài còn lại (SGK).
- Chuẩn bị bài luyện tập
Bài 46 : BENZEN VÀ ANKYLBENZEN
I. MỤC TIÊU :
1. Kiến thức :
HS biết
- Định nghĩa.
- Cấu trúc electron của benzen .
- Đồng đẳng , đồng phân và danh pháp của ankyl benzen .
- Tính chất vật lý tính chất hóa học của benzen và ankylbenzen .
HS hiểu :
- Sự liên quan giữa cấu trúc phân tử và tính chất hoá học của benzen .
2. Kỹ năng :
- Viết cấu trúc phân tử của benzen và một số chất trong dãy đồng đẳng
- Xác định công thức phân tử công thức cấu tạo , gọi tên
- Qui tắc thế ở nhân benzen để viết phương trình phản ứng điều chế các dẫn xuất
của benzen và ankyl benzen .
3. Thái độ :
-Nhận thức được tầm quan trọng củabenzen trong hoá hữu cơ.
II. CHUẨN BỊ :
GV mô hình phân tử benzen .
HS : Ôn lại tính chất của hiđrocacbon no , hđirocacbon không no .
IV. THIẾT KẾ CÁC HOẠT ĐỘNG :
1. ổn định lớp:
2. Bài mới
Hoạt động của thầy Hoạt động của trò
Nội dung
Hoạt động 1 : vào
bài
Aren là gì ? có
những tính chất gì ?
trong đời sống
thường gặp ở đâu ?
Hoạt động 2 :
- Cho HS quan sát
sơ đồ nhận xét về
liên kết và cấu trúc
phân tử C6H6 ?
Do 6 obitan p còn
lại của 6 nguyên tử
C xen với nhau tạo
thành liên kết
chung cho cả vòng
do đó lk ở
benzen tương đối
bền vững hơn so với
lk ở các
hiđrocacbon không
no khác .
GV hướng dẫn hai
kiểu CTCT của
benzen
Hoạt động 3 :
VD : C6H5CH3
C6H5CH2CH3
C6H5CH2CH2CH3
…
HS hoạt động
theo nhóm
- HS quan sát mô
hình và rút ra
nhận xét :
- Trạng thái lai
hóa của C
- Xen phủ bên
của các obitan p
tạo liên kết .
- Mặt phẳng
phân tử .
- Cất trúc phân
tử .
-Hs quan sát mô
hình đặc và mô
hình rỗng của
benzen .
- HS tìm hiểu
CTCT thu gọn
của 1 số đồng
đẳng của benzen
I – CẤU TRÚC , ĐỒNG ĐẲNG , ĐỒNG
PHÂN VÀ DANH PHÁP :
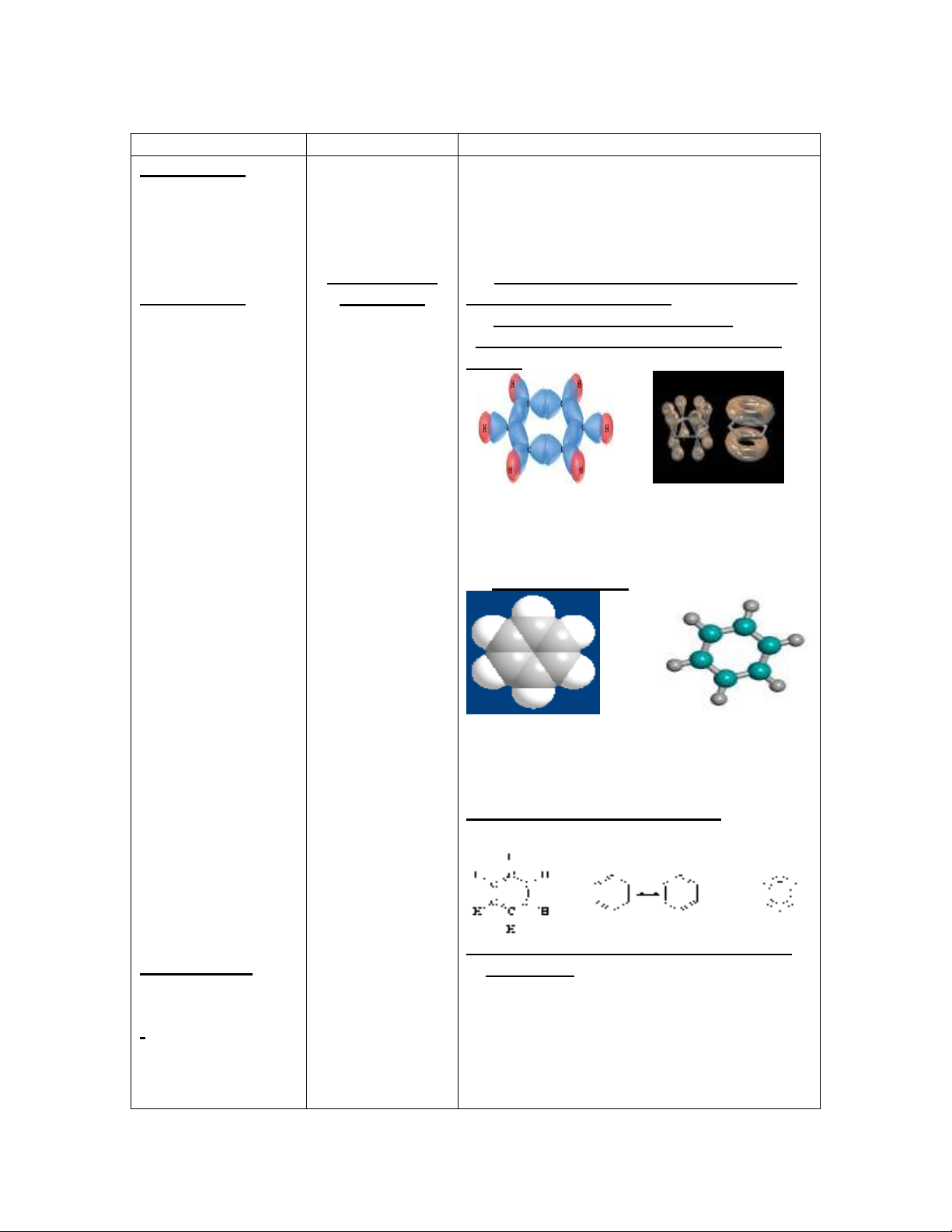
1 - Cấu trúc của phân tử benzen :
a/ Sự hình thành liên kết trong phân tử
benzen :
- Nguyên tử C ở trạng thái lai hóa sp2 .
- Các obital p của C xen phủ bên tạo thành
obital chung cho cả vòng ben zen .
- Liên kết ở benzen tương đối bền vững .
b/ Mô hình phân tử :
- Phân tử benzen có hình lục giác đều .
- Các nguyên tử nằm trong một mặt phẳng
các góc hóa trị đều bằng 1200 .
c/ Biểu diễn cấu tạo của benzen
:
2- Đồng đẳng ,đồng phân và danh pháp :
a/ Đồng đẳng :
-Khi thay các nguyên tử hiđro trong phân tử
benzen bằng các nhóm ankyl , ta được
nhóm ankylbenzen , hợp thành một dãy
đồng đẳng của benzen
- CnH2n-6 (n 6)


























