HÓA H C 8 - CHUYÊN Đ: CH T – NGUYÊN TỌ Ề Ấ Ử
- PHÂN TỬ
1. V t thậ ể
- V t th : Là toàn b nh ng gì xung quanh chúng ta và trong không gian.ậ ể ộ ữ
- V t th g m 2 lo i: V t th t nhiên và v t th nhân t o.ậ ể ồ ạ ậ ể ự ậ ể ạ
2. Ch tấ
- Ch t: là nguyên li u c u t o nên v t th . Ch t có kh p m i n i, đâu cóấ ệ ấ ạ ậ ể ấ ở ắ ọ ơ ở
v t th là đó có ch t.ậ ể ở ấ
- M i ch t có nh ng tính ch t nh t đnh. Bao g m tính ch t v t lý và tính ch tỗ ấ ữ ấ ấ ị ồ ấ ậ ấ
hoá h c.ọ
3. H n h pỗ ợ
- H n h p là 2 hay nhi u ch t tr n l i v i nhau. M i ch t trong h n h p đcỗ ợ ề ấ ộ ạ ớ ỗ ấ ỗ ợ ượ
g i là 1 ch t thành ph n.ọ ấ ầ
- H n h p g m có 2 lo i:ỗ ợ ồ ạ
+ H n h p đng nh t : là h n h p không xu t hi n ranh gi i phân cách gi a cácỗ ợ ồ ấ ỗ ợ ấ ệ ớ ữ
ch t thành ph n. VD: H n h p n c và r u.ấ ầ ỗ ợ ướ ượ
+ H n h p không đng nh t: là h n h p có xu t hi n ranh gi i phân cách gi aỗ ợ ồ ấ ỗ ợ ấ ệ ớ ữ
các ch t thành ph n.VD: H n h p d u ăn và n c.ấ ầ ỗ ợ ầ ướ
- Ch t tinh khi t là ch t không có l n ch t nào khác. Ch t tinh khi t có tính ch tấ ế ấ ẫ ấ ấ ế ấ
nh t đnh, không thay đi. VD: N c c t (n c tinh khi t)ấ ị ổ ướ ấ ướ ế
- Khi tách riêng các ch t ra kh i h n h p ta thu đc các ch t tinh khi t. Đấ ỏ ỗ ợ ượ ấ ế ể
tách riêng các ch t ra kh i h n h p ng i ta có th s d ng các ph ng phápấ ỏ ỗ ợ ườ ể ử ụ ươ
v t lý và hoá h c: tách, chi t, g n, l c, cho bay h i, ch ng c t, dùng các ph nậ ọ ế ạ ọ ơ ư ấ ả
ng hoá h c…ứ ọ
VD: Khu y tan m t l ng mu i ăn vào n c H n h p trong su t . Khi→ấ ộ ượ ố ướ ỗ ợ ố
đun nóng, n c bay h i, ng ng t h i t o thành n c c t. Sau khi c nướ ơ ư ụ ơ ạ ướ ấ ạ
n c thu đc mu i ăn.ướ ượ ố
4. Nguyên tử
- Nguyên t là h t vô cùng nh , trung hoà v đi n, c u t o nên các ch t.ử ạ ỏ ề ệ ấ ạ ấ
-C u t oấ ạ

Chú ý: Hiđro là nguyên t đc bi t ch có duy nh t m t h t proton.ử ặ ệ ỉ ấ ộ ạ
- Trong nguyên t , cácử e chuy n đng r t nhanh và s p x p thành t ng l p tể ộ ấ ắ ế ừ ớ ừ
trong ra ngoài.
+ L p 1: có t i đa 2eớ ố
+ L p 2, 3, 4… ớ t i đa 8eố
- Kh i l ng nguyên t = s P + s N + s e = s P + s N (vì e có kh i l ngố ượ ử ố ố ố ố ố ố ượ
r t nh nên b qua).ấ ỏ ỏ
5. Nguyên t hóa h c - Kí hi u hóa h cố ọ ệ ọ
- Là t p h p nh ng nguyên t cùng lo i, có cùng s proton trong h t nhân.ậ ợ ữ ử ạ ố ạ
- S proton là s đc tr ng c a 1 nguyên t .ố ố ặ ư ủ ố
- Kí hi u hóa h cệ ọ : M i nguyên t đc bi u di n b ng 1 kí hi u hóa h cỗ ố ượ ể ễ ằ ệ ọ
(KHHH)
VD: + Nguyên t Natri đc kí hi u : Na + Nguyên t Oxi đc kí hi u:ố ượ ệ ố ượ ệ
O
6. Nguyên t kh iử ố
- Đn v cacbon: theo qui c, ng i ta l y ơ ị ướ ườ ấ kh i l ng c a nguyên tố ượ ủ ử
cacbon làm đn v kh i l ng nguyên t , g i là đn v cacbon.ơ ị ố ượ ử ọ ơ ị
VD: C = 12 đvC, H = 1 đvC; O = 16 đvC; Ca = 40 đvC; Cl = 35,5 đvC…
- Nguyên t kh i: là kh i l ng c a 1 nguyên t tính b ng đn v cacbon.ử ố ố ượ ủ ử ằ ơ ị
- M i nguyên t có nguyên t kh i riêng bi t.ỗ ố ử ố ệ
- Có trên 110 nguyên t (trong đó có 92 nguyên t t nhiên).ố ố ự
- Oxi là nguyên t ph bi n nh t.ố ổ ế ấ
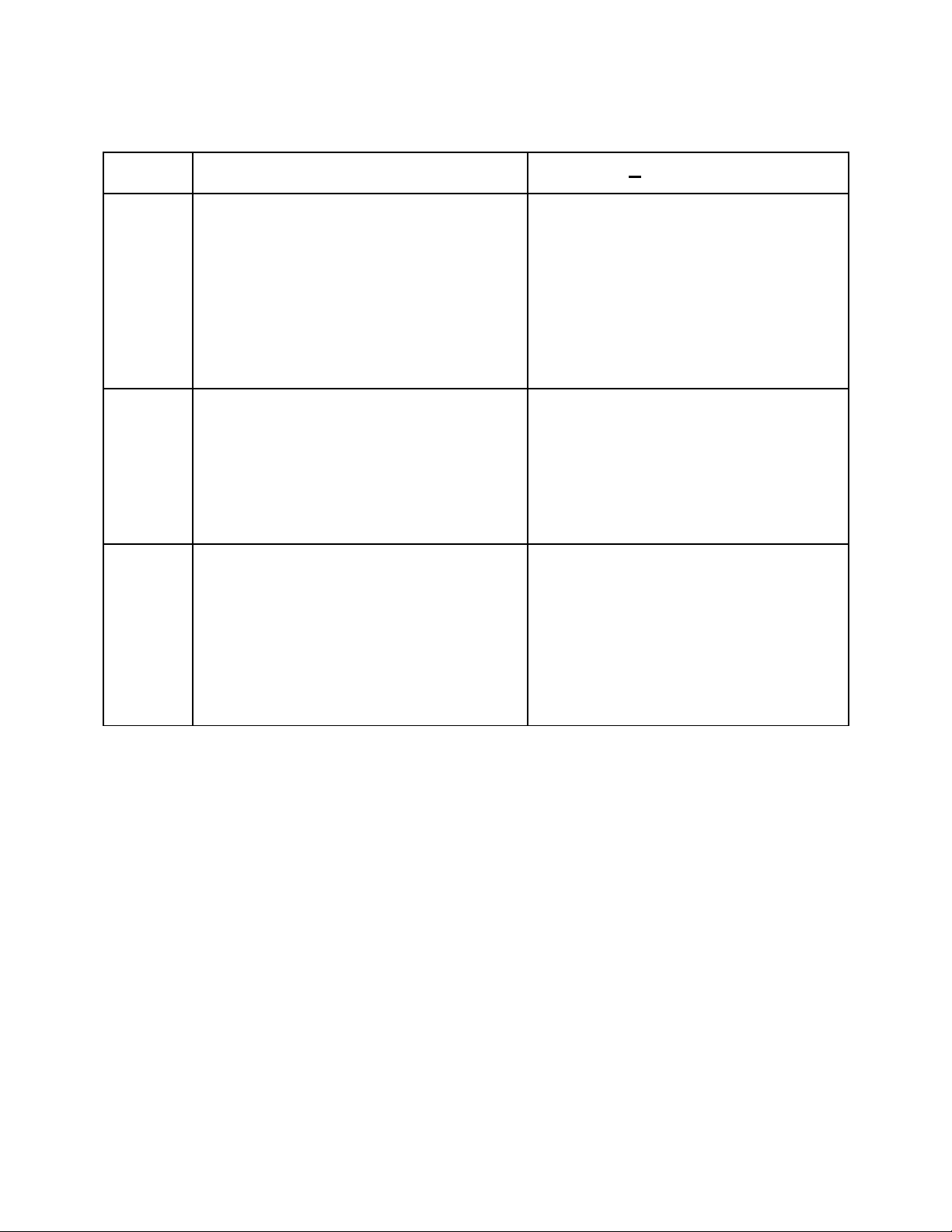
7. Đn ch t - H p ch tơ ấ ợ ấ
Đn ch tơ ấ H p ch tợ ấ (AxBy)
1.Đnhị
nghĩa
Đn ch t do 1 nguyên t hoá h cơ ấ ố ọ
c u t o nên.ấ ạ
VD:- Khí oxi t o nên t nguyên tạ ừ ố
O.
- K.lo i nhôm t o nên t nguyên tạ ạ ừ ố
Al.
H p ch t là nh ng ch t t o nênợ ấ ữ ấ ạ
t 2 NTHH tr lên.ừ ở
VD:- N c: Hướ 2O Nguyên t H và ố
O.
-Axit sunfuric: H2SO4 Nguyên tố
H, S và O
2.Phân
lo iạ+ Đn ch t kim lo i (A): D nơ ấ ạ ẫ
đi n, d n nhi t, có ánh kim.ệ ẫ ệ
+ Đn ch t phi kim (Aơ ấ x): Không
d n đi n, d n nhi t, không có ánhẫ ệ ẫ ệ
kim.
+ H p ch t vô c : Hợ ấ ơ 2O, NaOH,
NaCl, H2SO4....
+ H p ch t h u c :CHợ ấ ữ ơ 4 (Mê tan),
C12H22O11 (đng)…ườ
3.c uấ
t oạ+ Đn ch t KL: Nguyên t s pơ ấ ử ắ
x p khítế nhau và theo m t tr t tộ ậ ự
xác đnh.ị
+ Đn ch t PK: Nguyên t liên k tơ ấ ử ế
v i nhau theo m t s nh t đnhớ ộ ố ấ ị
(Th ng là 2).ườ
- Trong h p ch t: Nguyên t liênợ ấ ố
k t v i nhau theo m t t l vàế ớ ộ ỷ ệ
m t th t nh t đnhộ ứ ự ấ ị
8. Phân t - ửPhân t kh iử ố
- Phân t là h t đi di n cho ch t, g m m t s nguyên t liên k t v i nhau vàử ạ ạ ệ ấ ồ ộ ố ử ế ớ
th hi n đy đ tính ch t hoá h c c a ch t.ể ệ ầ ủ ấ ọ ủ ấ
VD: - Khí hiđro, oxi : 2 nguyên t cùng lo i liên k t v i nhau.ử ạ ế ớ
- N c : 2H liên k t v i 1O.ướ ế ớ
- Phân t kh i là kh i l ng phân t tính b ng đn v cacbon. Phân t kh iử ố ố ượ ử ằ ơ ị ử ố
b ng t ng nguyên t kh i c a các nguyên t trong phân t .ằ ổ ử ố ủ ử ử
VD:O2 = 2.16 = 32 đvC ; Cl2 = 71 đvC.
CaCO3 = 100 đvC ; H2SO4 = 98 đvC.
- M i m u ch t là m t t p h p vô cùng l n nh ng h t nguyên t hay phân t .ỗ ẫ ấ ộ ậ ợ ớ ữ ạ ử ử

- Tu đi u ki n m i ch t có th 3 tr ng thái: r n, l ng, khí tr ng thái khíỳ ề ệ ỗ ấ ể ở ạ ắ ỏ ở ạ
các h t cách xa nhau.ạ
B. CÁC D NG BÀI T P Ạ Ậ
D NG 1. PHÂN BI T V T TH VÀ CH TẠ Ệ Ậ Ể Ấ
- V t th : là hình d ng v t d ng t nhiên và nhân t o.ậ ể ạ ậ ụ ự ạ
- Ch t: là thành ph n (nguyên li u) c u t o nên v t th .ấ ầ ệ ấ ạ ậ ể
Bài t p 1.ậ Phân bi t đâu là v t th , đâu là ch t trong các ý sau:ệ ậ ể ấ
1. L p, ru t xe làm b ng cao su.ố ộ ằ
2. Bóng đèn đi n đc ch t o t th y tinh, đng, vonfram (vonfram là kimệ ượ ế ạ ừ ủ ồ
lo i ch u nóng).ạ ị
3. Cây mía ch a n c, đng saccaroz và bã (xenluloz ).ứ ướ ườ ơ ơ
4. Qu chanh ch a n c, axit citric…ả ư ướ
H ng d nướ ẫ
V t thậ ể Ch tấ
a. l p, ru t xeố ộ cao su
b. bóng đèn đi nệth y tinh, đng, vonframủ ồ
c. cây mía n c, đng saccaroz , xenlulozướ ườ ơ ơ
d. qu chanhản c, axit citricướ
Bài t p 2.ậ Các ch t sau t n t i v t th t nhiên, v t th nhân t o nào?ấ ồ ạ ở ậ ể ự ậ ể ạ
1. G (thành ph n chính là xenluloz )ỗ ầ ơ
2. Cao su
3. Tinh b tộ
H ng d nướ ẫ
V t th t nhiênậ ể ự V t th nhân t oậ ể ạ
a. G :ỗthân cây mít, cây b ch đàn, cây ph ng ạ ượ
vĩ,….
Bàn, gh , t g , gi ng g ….ế ủ ỗ ườ ỗ
b. Cao su: nh a cây sao suựL p, ru t xe ô tô, xe máy, n mố ộ ệ
cao su…..
c. Tinh b t:ộh t lúa, c s n…..ạ ủ ắ Bánh dày, bánh đa, bánh quy…
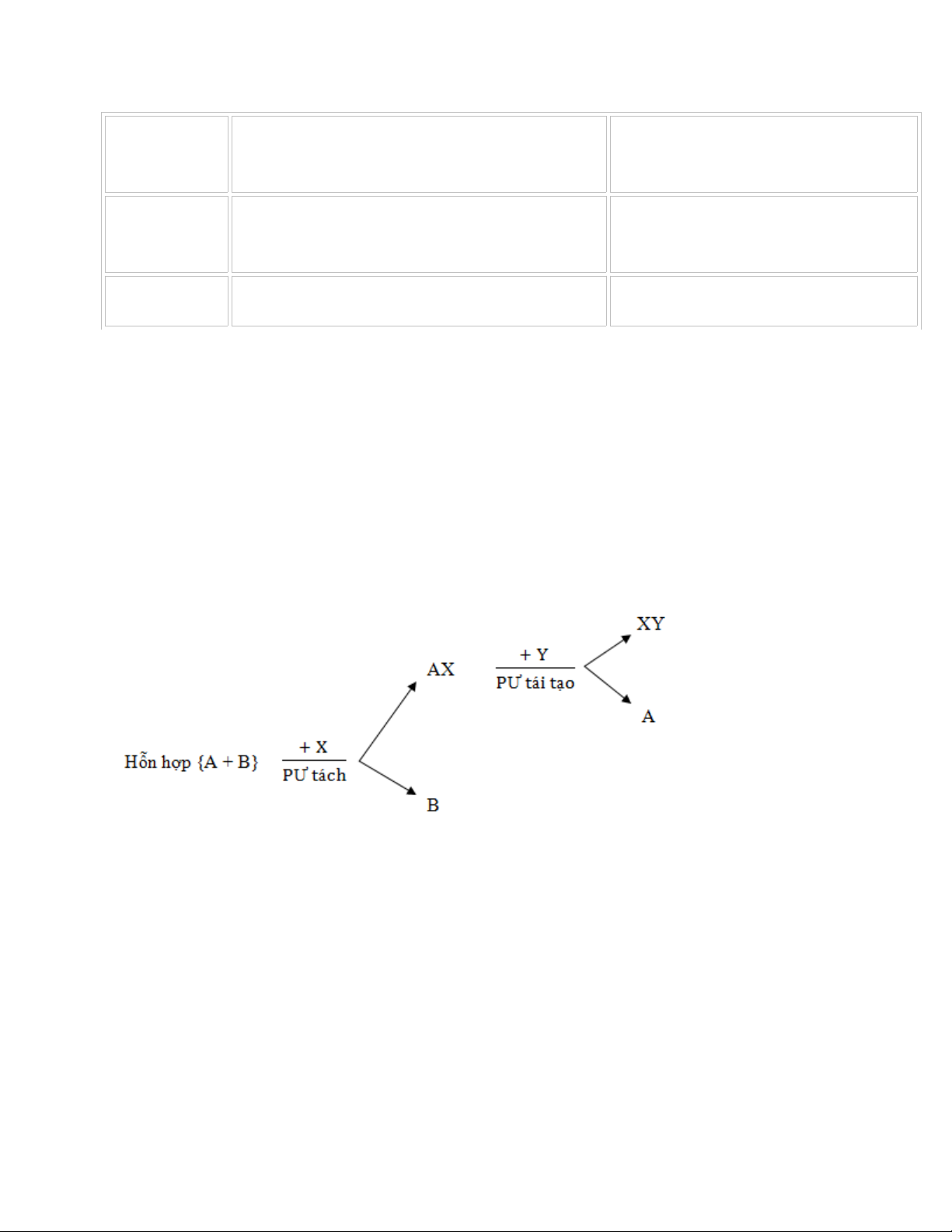
D NG 2: TÁCH, TINH CH CH T RA KH I H N H PẠ Ế Ấ Ỏ Ỗ Ợ
* Tách b ng ph ng pháp v t líằ ươ ậ
- D a vào tính ch t: các ch t thành ph n luôn gi nguyên tính ch t c a nó trongự ấ ấ ầ ữ ấ ủ
h n h pỗ ợ
- Có th s d ng các cách sau: l c, cô c n, ch ng c t phân đo n làm đông đc,ể ử ụ ọ ạ ư ấ ạ ặ
chi t…ế
* Tách b ng ph ng pháp hóa h cằ ươ ọ
- Dùng ph n ng hóa h c:ả ứ ọ
- Ph ng pháp này c n th a mãn các yêu c u sau:ươ ầ ỏ ầ
Ch tác d ng lên m t ch t trong h n h p c n tách.ỉ ụ ộ ấ ỗ ợ ầ
S n ph m t o thành có th tách d dàng ra kh i h n h p.ả ẩ ạ ể ễ ỏ ỗ ợ
S n ph m có kh năng tái t o ch t ban đu.ả ẩ ả ạ ấ ầ
Bài t p1.ậ Tách mu i ăn ra kh i h n h p mu i ăn.ố ỏ ỗ ợ ố
H ng d n:ướ ẫ Đun sôi h n h p, khi nhi t đ h n h p đt 100ỗ ợ ệ ộ ỗ ợ ạ 0C thì n c b cướ ố
h i, ta s còn l i mu i ăn.ơ ẽ ạ ố

![Liên kết gen và hoán vị gen: Chuyên đề [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2021/20210619/yensinhmk/135x160/6591624072920.jpg)