
KHOA CN SINH H C – MÔI TR NG Ọ ƯỜ THÍ NGHI M HÓA Ệ
SINH
M T S PH NG PHÁP T A PROTEINỘ Ố ƯƠ Ủ
I. Ph ng pháp t a b ng các tác nhân gây t a là dung môi h u c (Ethanolươ ủ ằ ủ ữ ơ
80%, Aceton)
Đ hòa tan c a protein trong dung d ch ph thu c vào nhi u y u t , m t trong sộ ủ ị ụ ộ ề ế ố ộ ố
đó là h ng s đi n môi c a dung d ch. Nhìn chung, nh ng phân t dung môi có h ng sằ ố ệ ủ ị ữ ử ằ ố
đi n môi l n (nh n c, dimethylsulphoxid) có th n đnh t ng tác gi a chúng v i cácệ ớ ư ướ ể ổ ị ươ ữ ớ
phân t protein và t o đi u ki n thu n l i cho s hòa tan c a protein trong dung d ch.ử ạ ề ệ ậ ợ ự ủ ị
Ng c l i, các dung môi v i h ng s đi n môi nh (aceton, ethanol…) ngăn c n s phânượ ạ ớ ằ ố ệ ỏ ả ự
tán c a các phân t protein trong môi tr ng. Do đó, đ hòa tan c a nh ng phân t proteinủ ử ườ ộ ủ ữ ử
gi m và x y ra k t t a do s làm gi m h ng s đi n môi hi n h u c a môi tr ng. Đi uả ả ế ủ ự ả ằ ố ệ ệ ữ ủ ườ ề
này có đc b ng cách thêm m t dung môi hòa tan trong n c nh aceton vào dung d chượ ằ ộ ướ ư ị
ch a protein. S t a b ng aceton ho c ethanol 80% có nhi u thu n l i h n vì nó t ngứ ự ủ ằ ặ ề ậ ợ ơ ươ
đi r , có s n d ng tinh khi t v i ít ch t t p nhi m gây đc hay c ch đi v i enzym,ố ẻ ẵ ở ạ ế ớ ấ ạ ễ ộ ứ ế ố ớ
do nhi t đ bay h i c a dung môi th p nên d tách b dung môi kh i ch ph m enzymệ ộ ơ ủ ấ ễ ỏ ỏ ế ẩ
b ng ph ng pháp s y nh b ng qu t gió.ằ ươ ấ ẹ ằ ạ
II. Ph ng pháp t a b ng mu iươ ủ ằ ố
Ng i ta có th dùng mu i (NHườ ể ố 4)2SO4, NaCl… đ t a protein vì các mu i này v aể ủ ố ừ
làm trung hòa đi n (do các ion tác đng t ng h v i các nhóm tích đi n trái d u), v aệ ộ ươ ỗ ớ ệ ấ ừ
lo i b l p v hydrat c a phân t protein. Các protein khác nhau có th b k t t a v iạ ỏ ớ ỏ ủ ử ể ị ế ủ ớ
n ng đ mu i khác nhau, vì v y có th dùng mu i đ tách riêng các protein ra kh i h nồ ộ ố ậ ể ố ể ỏ ỗ
h p c a chúng. ợ ủ
Ph n thí nghi mầ ệ
1. D ng c và hóa ch tụ ụ ấ
D ng cụ ụ
Pipet 5ml, 10ml
Becher 50ml, 100ml, 250ml
Bình tia
Máy ly tâm
Hóa ch tấ
Nguyên li u th m (d a)ệ ơ ứ
Etanol 96%
Mu i (NHố4)2SO4
2. Th c hành ự
Cân kho ng 80g đn 100g th m, giã nát v t l y n c r i ly tâm 6000 vòng/phútả ế ơ ắ ấ ướ ồ ở
trong 15 phút r i đong xem th tích c a n c th m là bao nhiêu, ghi nh n th tích V. Sauồ ể ủ ướ ơ ậ ể
1
KHOA CN SINH H C – MÔI TR NG Ọ ƯỜ THÍ NGHI M HÓA Ệ
SINH
đó chia đôi th tích V n c th m vùa thu đc thành hai ph n b ng nhau r i ti n hànhể ướ ơ ượ ầ ằ ồ ế
t a protein b ng hai tác nhân t a khác nhau: Ethanol 80% và mu i (NHủ ắ ủ ố 4)2SO4
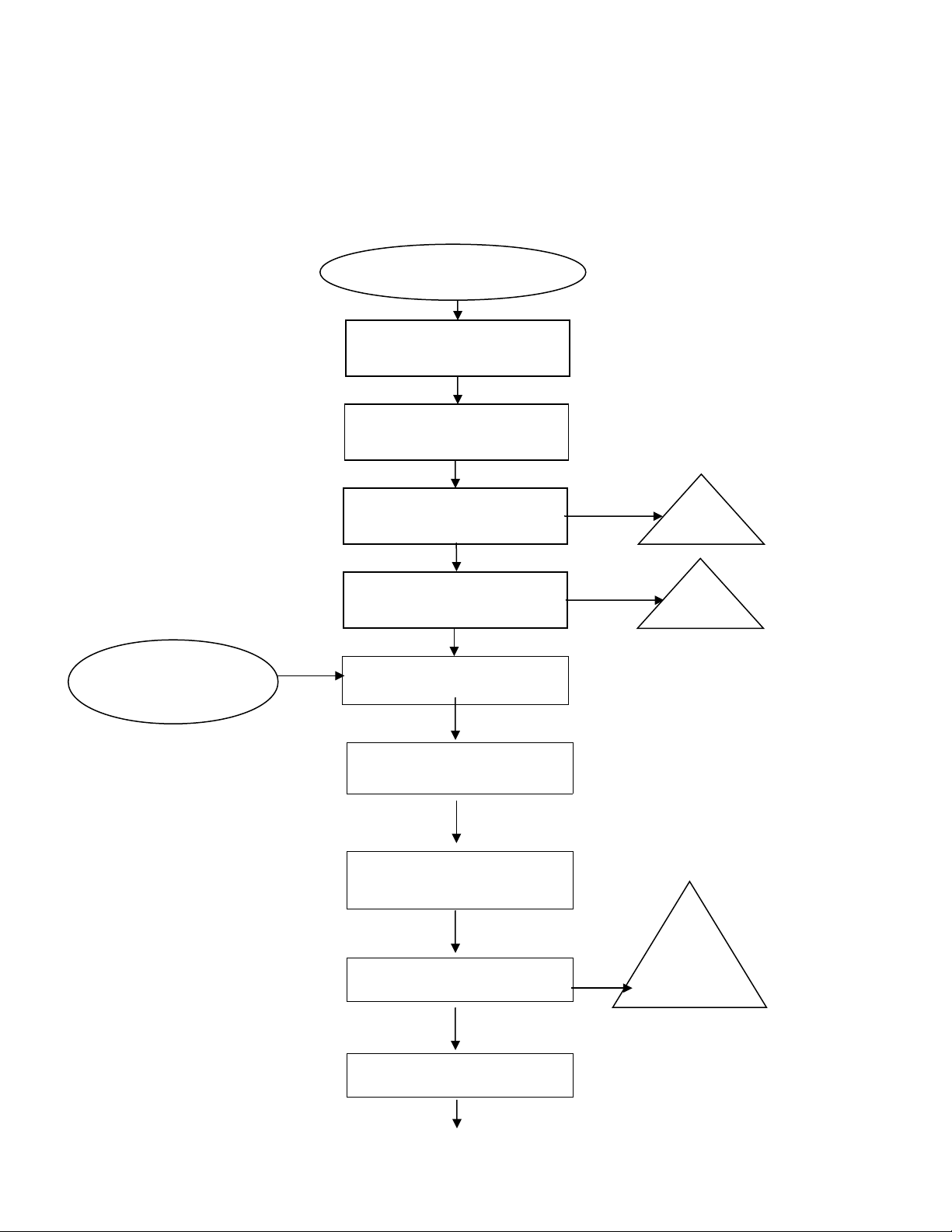
Quy trình k t t a enzym Bromelin b ng c n 80%ế ủ ằ ồ
2
Làm s chạ
Nghi n ép, xay nhuy nề ễ
L cọ
Ly tâm 6000 v/p, trong
15 phút
D ch trongị
Ch i ng n, v quồ ọ ỏ ả
Bã
Bã
T a c n 4ủ ồ oC / 2 gi ờ
Ly tâm 6000 v/p, trong
20 phút
Thu t aủ
S y khôấ
B ỏ
d ch ị
trong
c n 80%, làm ồ
l nh 4ạ0C
KHOA CN SINH H C – MÔI TR NG Ọ ƯỜ THÍ NGHI M HÓA Ệ
SINH
L u ý: Ph i tr n c n v i d ch d a theo t l 4:1 (1 d a : 4 c n)ư ố ộ ồ ớ ị ứ ỉ ệ ứ ồ
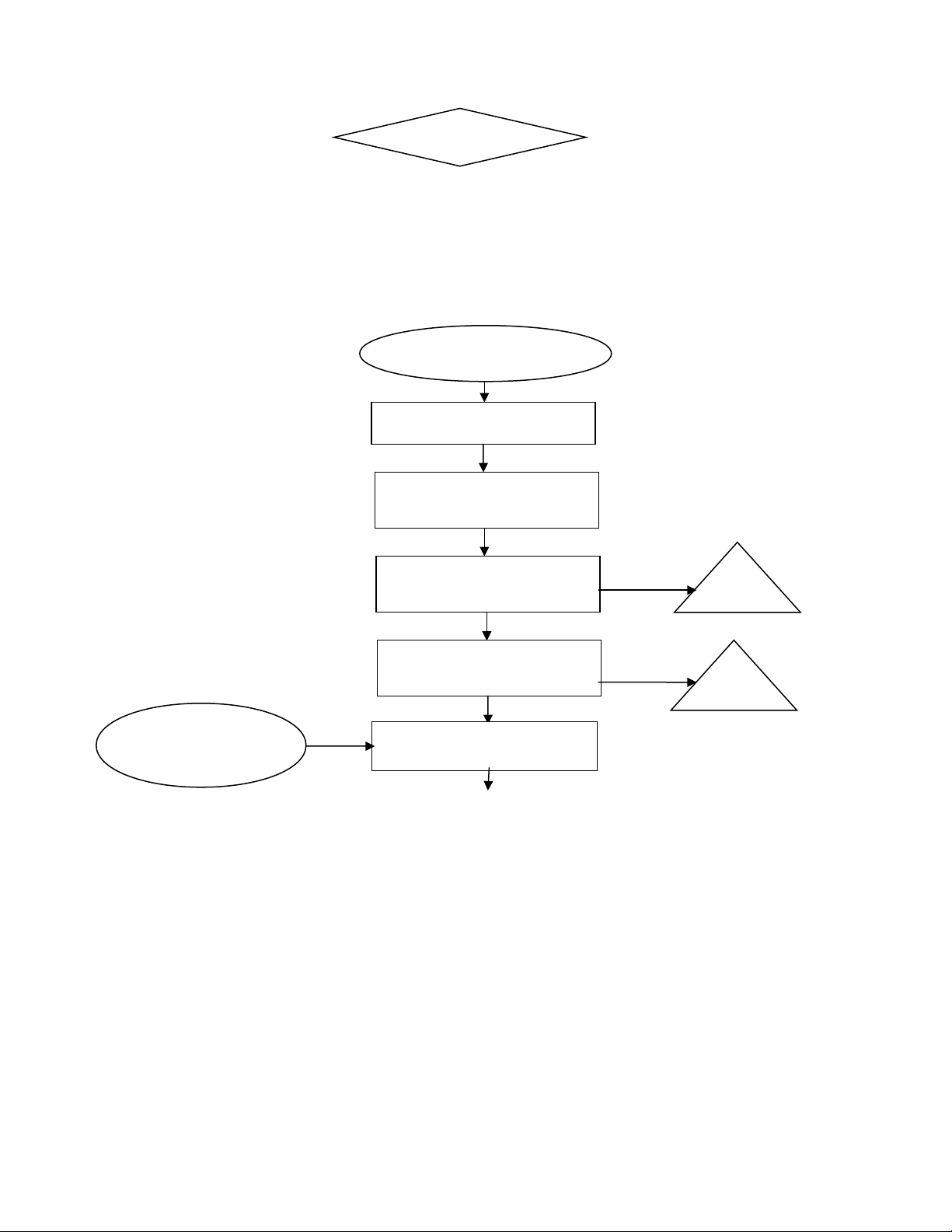
Quy trình thu nh n enzym Bromelin b ng mu i (NHậ ằ ố 4)2SO4
3
Làm s chạ
Nghi n ép, xay nhuy nề ễ
L cọ
Ly tâm 6000 v/p, 15 –
20phútBã
Bã
Ch i ng n, v ồ ọ ỏ
quả
Bromelin
D ch trongị
Ammonium
sulfate 70%
bão hòa
KHOA CN SINH H C – MÔI TR NG Ọ ƯỜ THÍ NGHI M HÓA Ệ
SINH
L u ýư: Đ có mu i(NHể ố 4)2SO4 bão hòa 70% ta ph i tr n v i t l 47,2g mu i trongố ộ ớ ỷ ệ ố
100ml n c th m.ướ ơ
3. K t qu : ế ả Hãy tính hàm l ng protein có trong 100g nguyên li u ban đu.ượ ệ ầ
III. Ph ng pháp t a protein b ng đi m đng đi n.ươ ủ ằ ể ẳ ệ
1. Nguyên t cắ
Giá tr pH mà t i đó phân t protein trung hòa đi n g i là đi m đng đi n c aị ạ ử ệ ọ ể ẳ ệ ủ
protein (pI), giá tr pH = pI phân t protein trung hòa đi n s không chuy n d ch trongở ị ử ệ ẽ ể ị
đi n tr ng, phân t protein s kém b n nh t d k t t a.ệ ườ ử ẽ ề ấ ễ ế ủ
Ng i ta l i d ng tính ch t này đ k t t a protein.ườ ợ ụ ấ ể ế ủ
2. D ng c và hóa ch tụ ụ ấ
D ng c ụ ụ
Máy khu t tấ ừ
Máy ly tâm
Cân phân tích
Bercher 100ml, 250ml
Pipet 5ml, 10ml
Hóa ch tấ
Dung d ch NaOH 20%ị
Dung d ch HCl 10%ị
Ete
Etanol
Gi y pHấ
3. Th c hànhự
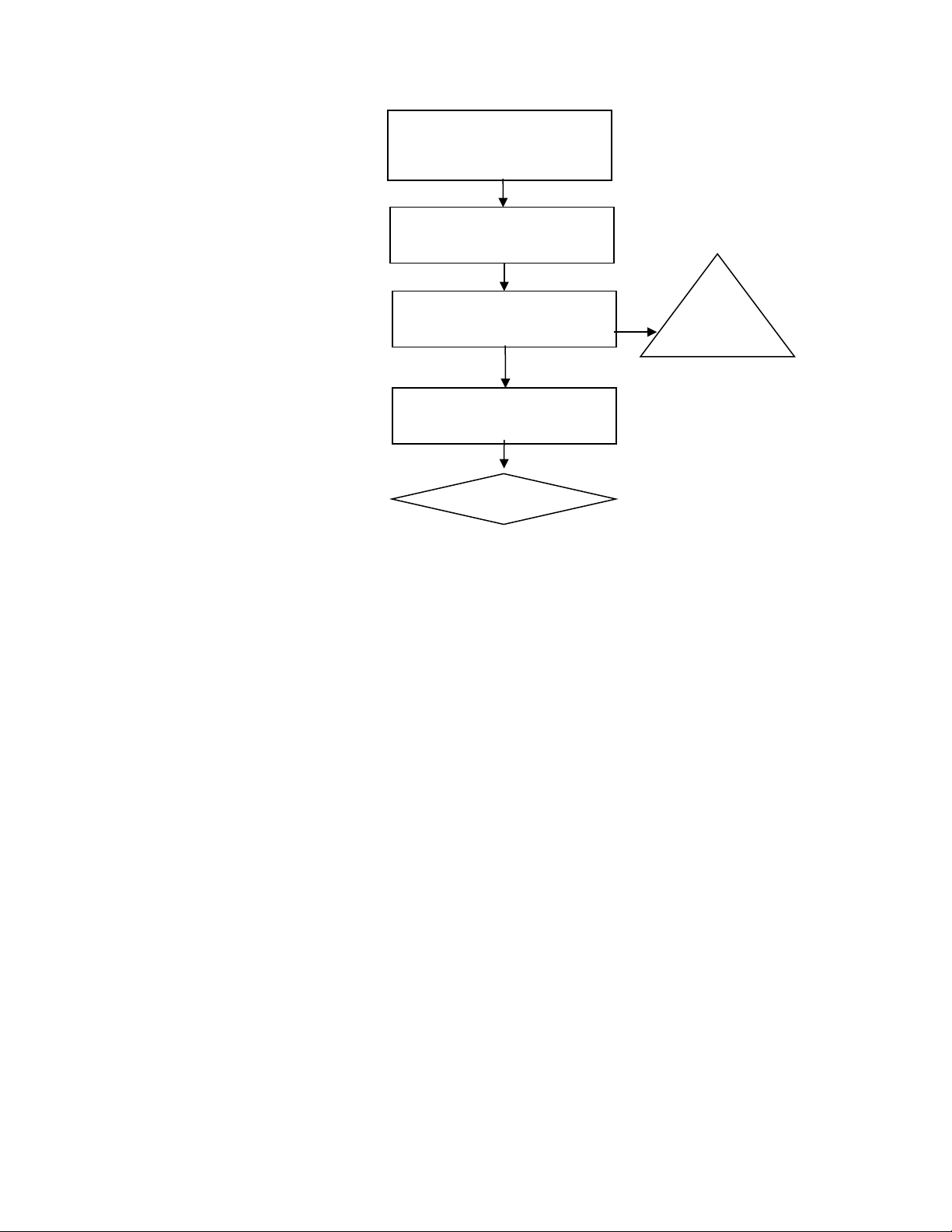
Tách chi t protein cá:ế
4
H n h p d ch d a, đ ỗ ợ ị ứ ể
nhi t đ phòng 30 ở ệ ộ
phút
Ly tâm 6000 v/p, trong
15 phút
Thu t aủB ỏ
d ch ị
trong
S y khôấ
Bromelin

KHOA CN SINH H C – MÔI TR NG Ọ ƯỜ THÍ NGHI M HÓA Ệ
SINH
Cân 100g cá đã xay nhuy n trong m t bercher r i cho 4 l n n c. (1 cá : 4 n c,ễ ộ ồ ầ ướ ướ
g/l)
Khu y đu r i cho t t NaOH 20% v a cho v a khu y cho đn pH 11 th b ng gi yấ ề ồ ừ ừ ừ ừ ấ ế ử ằ ấ
pH, khu y kho ng 45 phút r i ly tâm, gi l i d ch chi t trong m t bercher 250ml, bã cònấ ả ồ ữ ạ ị ế ộ
l i thêm n c chi t ti p l n hai r i ly tâm l y d ch b bã. D ch thu đc cho vào bercherạ ướ ế ế ầ ồ ấ ị ỏ ị ượ
250ml g p chung v i ph n d ch chi t bên trên.ộ ớ ầ ị ế
Cho t t HCl 100% vào d ch chi t v a cho v a khu y đn pH thích h p là 6 sừ ừ ị ế ừ ừ ấ ế ợ ẽ
th y k t t a, ly tâm 4000 vòng/phút trong 30 phút, r i b d ch thu t a protein, r a t a v iấ ế ủ ồ ỏ ị ủ ử ủ ớ
ete : ethanol v i t l 2:1, t a protein s ch khi r a t a vài l n v i ete : ethanol. Cân l ngớ ỷ ệ ủ ạ ử ủ ầ ớ ượ
t a protein thu đc (mg t a) đ tính ra hi u su t protein có trong 100g cá.ủ ượ ủ ể ệ ấ
KH O SÁT HO T TÍNH ENZYM BROMELINẢ Ạ
(Xác đnh ho t tính enzym Bromelin b ng ph ng pháp Anson c i ti n)ị ạ ằ ươ ả ế
1. Nguyên t c ắ
Ph ng pháp này d a trên s th y phân protein casein b ng enzym Bromelin cóươ ự ự ủ ằ
trong d ch nghiên c u, ti p đó làm vô ho t enzym và k t t a protein ch a b th y phânị ứ ế ạ ế ủ ư ị ủ
b ng dung d ch acid trichloracetic. Đnh l ng s n ph m đc t o thành trong ph n ngằ ị ị ượ ả ẩ ượ ạ ả ứ
th y phân b ng ph n ng màu v i thu c th Folin. D a vào đ th chu n c a Tyrosin đủ ằ ả ứ ớ ố ử ự ồ ị ẩ ủ ể
tính l ng s n ph m do enzym xúc tác t o nên.ượ ả ẩ ạ
2. D ng c và hóa ch tụ ụ ấ
D ng cụ ụ
ng nghi mỐ ệ
Pipet 1ml, 2ml, 3ml, 5ml, 10ml
Máy quang phổ
5


























