ĐẠI CƯƠNG HÓA PHÂN TÍCH
Mc tiêu hc tp
• Trnh by đưc đi tưng, chc năng
v phân loi ca ha hc phân tch.
• Nêu đưc ni dung ca ha hc phân
tch.
• Gii thch đưc cc bưc thc hin
ca qui trnh phân tch

LỊCH SỬ
Từ thuật gi kim (Alchemy) đến ha hc (chemistry)
- Đất đá nóng chy thành kim loi.
- Hai chất pha trn vi nhau bc cháy.
- Nưc ép từ mt s cây cỏ chữa trị bnh.
Con người bắt đầu suy nghĩ kết hp quan
sát vi thử nghim để c gắng tìm hiểu bn
chất thế gii = nhà gi kim thuật (Alchemist).
- Thay đổi các kim loi phổ biến thành vàng
- Tìm ra mt loi thuc mà có thể chữa bá
bnh, thuc “ci lão hoàn đồng”.
Đến năm 1600 , các nhà gi kim thuật đã hc
cách quan sát và thử nghim để có thông tin
hữu ích hơn c ma thuật và phép thuật đưc
gán cho trưc đ bởi thuật gi kim. H đã hc
đưc cách to ra gi thuyết, thu thập chng
c và đi đén kết luận. HÓA HỌC ra đời

LỊCH SỬ
- Phân tích h thng các nguyên t bởi Justus von
Liebig (Đc, 1803 – 1873)
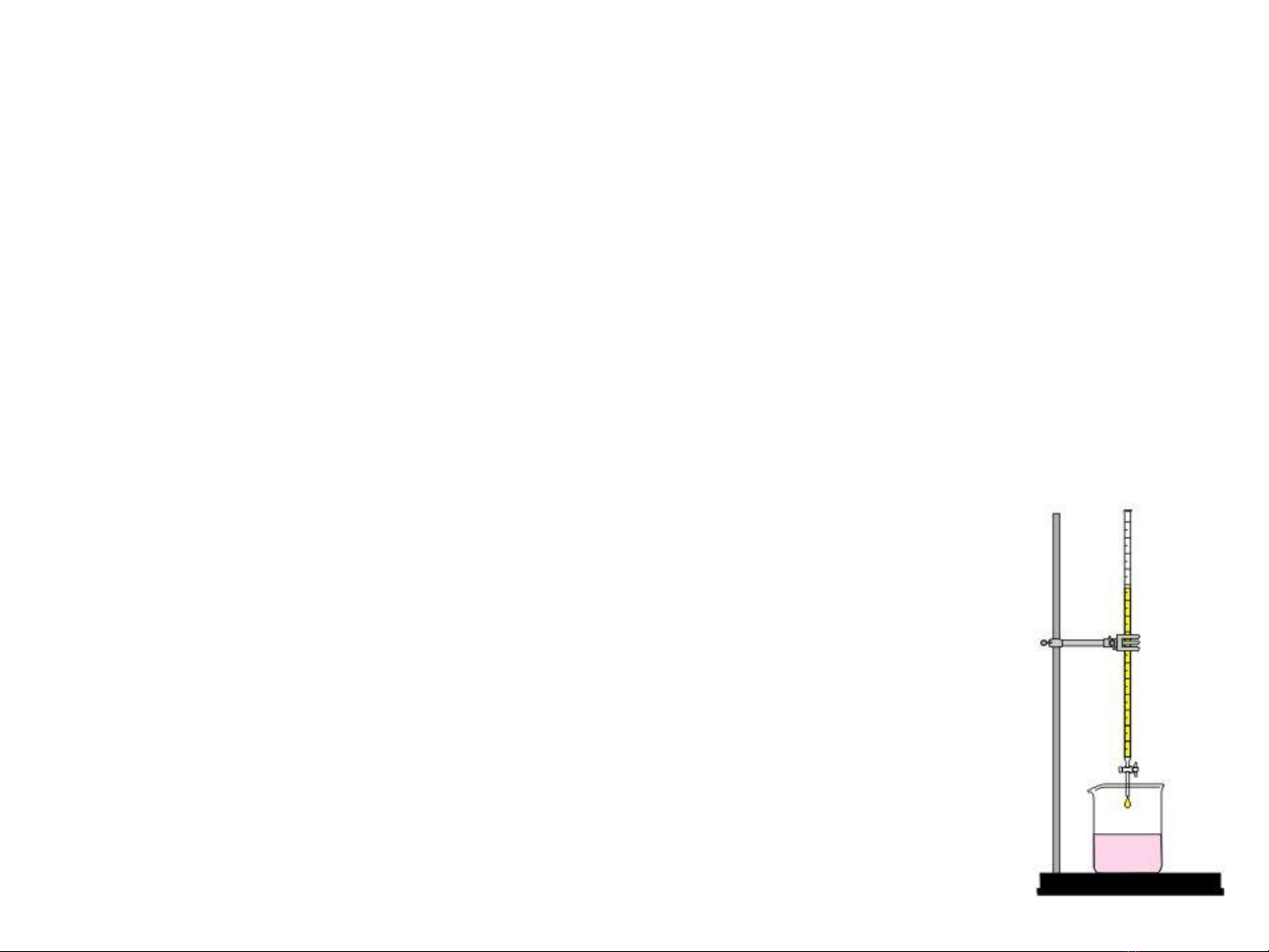
Nhóm Ion Thuc thử
nhóm
Đặc điểm
I Ag+, Pb2+,
Hg22+
HCl 6M Ta clorid màu trắng, không tan
/ HNO3
II Ba2+, Sr2+,
Ca2+
H2SO4 3M Ta sulfat, không tan/ acid vô
cơ, a. acetic
III Al3+, Cr3+,
Zn2+
NaOH 3M Hydroxyt lưỡng tính, tan /kiềm
dư
IV Fe3+, Mn2+,
Mg2+, Bi3+
NaOH + H2O2 Hydroxyt không tan/ kiềm dư
V Cu2+, Co2+ ,
Hg2+
NH4OH Hydroxyt, to phc tan /
NH4OH dư
VI Na+, K+, NH4+ Không có
LỊCH SỬ
- Phân tích h thng các nguyên t bởi Justus von
Liebig (Đc, 1803 – 1873)
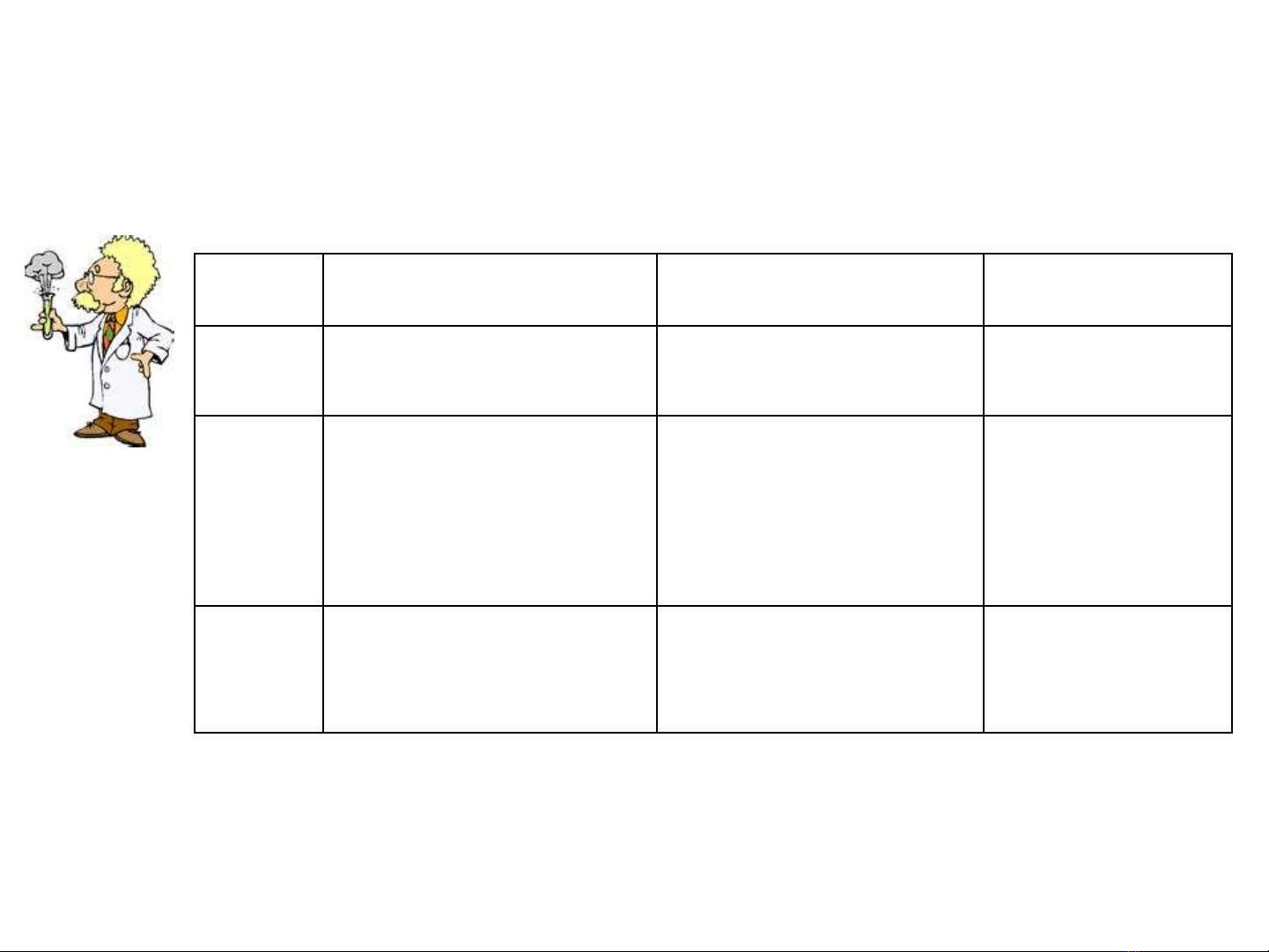
Nhóm Ion Thuốc thử Đặc điểm
I Cl-, Br-, I-, SCN- AgNO3/HNO3 Ta
II SO42-, CO32-, PO43-,
BO2-, C2O42-
BaCl2 Ta trắng
tan/acid trừ
BaSO4
III NO3-, MnO4- Không c thuc thử
nhóm
LỊCH SỬ
- Phn ng định tính các nguyên t và các nhóm chc
(nhiều nhà khoa hc)
- Phát triển mnh sau 1900 nhờ vào thành tu ca
khoa hc “phân tích công cụ” (Instrumental analysis)






![Bài giảng Công nghệ chuyển hóa than: Phần 8 (2) - Văn Đình Sơn Thọ [Full]](https://cdn.tailieu.vn/images/document/thumbnail/2015/20151224/kiepnaybinhyen_04/135x160/4821450944267.jpg)
![Bài giảng Công nghệ chuyển hóa than: Phần 8 (1) - Văn Đình Sơn Thọ [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2015/20151224/kiepnaybinhyen_04/135x160/2751450944269.jpg)











![Bài giảng Chế biến khoáng sản vô cơ [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251025/thanhvan173002/135x160/21521761538638.jpg)






