
PHƯƠNG PHÁP ĐIỆN THẾ KẾ
1

lĐo hiệu thế giữa hai điện cực nhúng vào một dung
dịch nhất định
lmột điện cực so sánh có thế không đổi/Reference
electrode: maintains a fixed (reference) potential
lmột điện cực chỉ thị có thế thay đổi theo bản chất và nồng
độ của ion cần xác định./Indicator (working) electrode:
responds to analyte activity
lTừ thế E thay đổi có thể suy ra hoạt độ hoặc nồng độ
của ion cần xác định dựa trên phương trình Nernst.
lHệ hoạt động không dòng (i=0) hay i rất nhỏ, không
có phản ứng điện hóa xảy ra, thành phần dung dịch
không đổi.
2
Nguyên lý
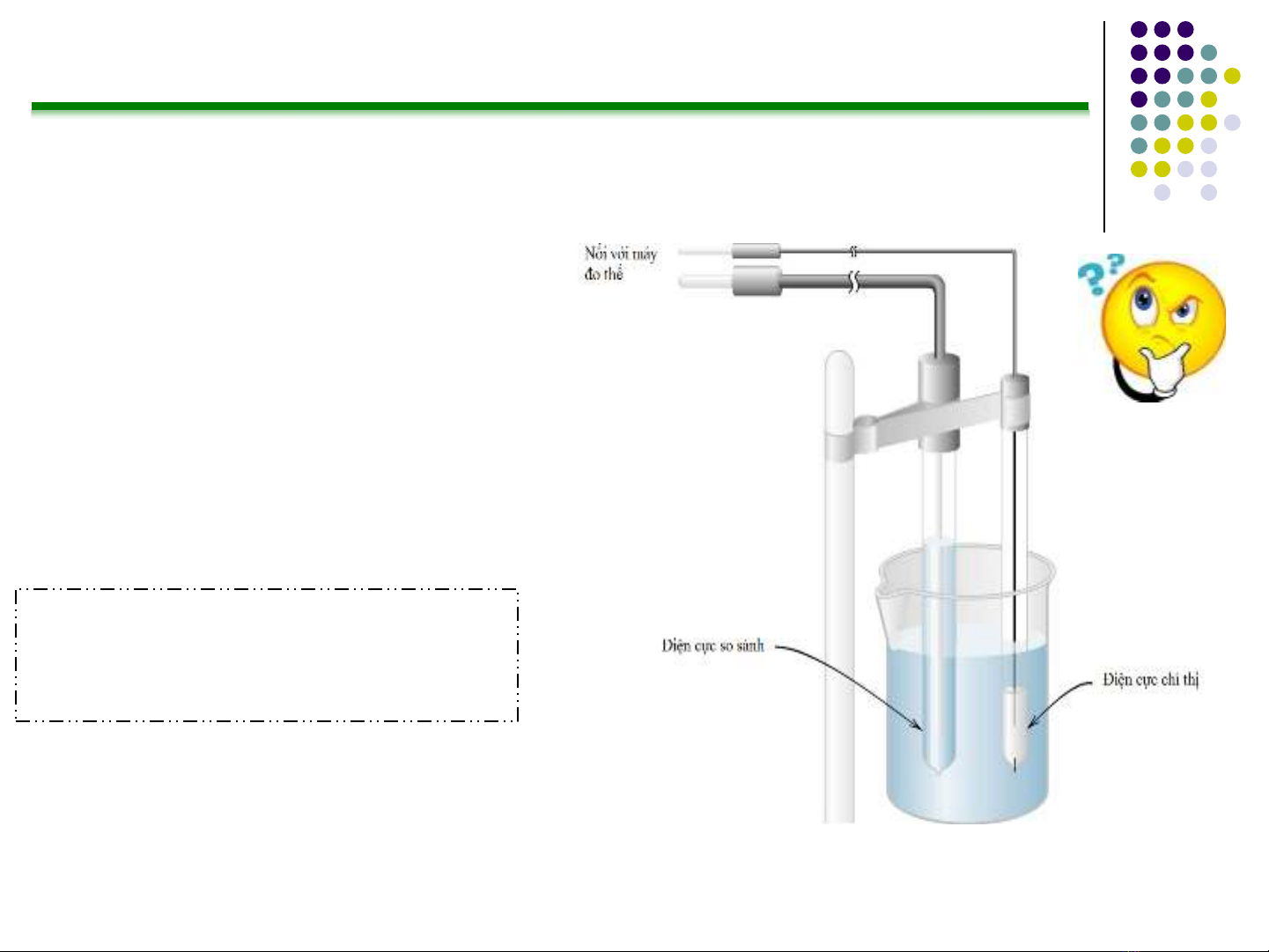
lĐiện cực so sánh (RE)
lĐiện cực chỉ thị (IE)
lCầu muối (SB)
lDung dịch phân tích (A)
lMột máy đo thế
RE
½
SB
½
A
½
IE
– Eref + Ej+ Eind
3
Cho biết
đâu là cầu
muối trong
hình vẽ?
Cấu tạo hệ đo thế

lĐiện cực có thế hằng định và biết trước.
lThế tuân theo phương trình Nernst và trở lại thế
ban đầu khi chịu một dòng điện rất nhỏ. Phản
ứng điện cực hoàn toàn thuận nghịch
lThế ít thay đổi theo nhiệt độ
lĐộ lặp lại cao, dễ chế tạo, dễ bảo quản
lKhông nhạy với chất phân tích
4
Điện cực so sánh
Yêu cầu của điện cực so sánh
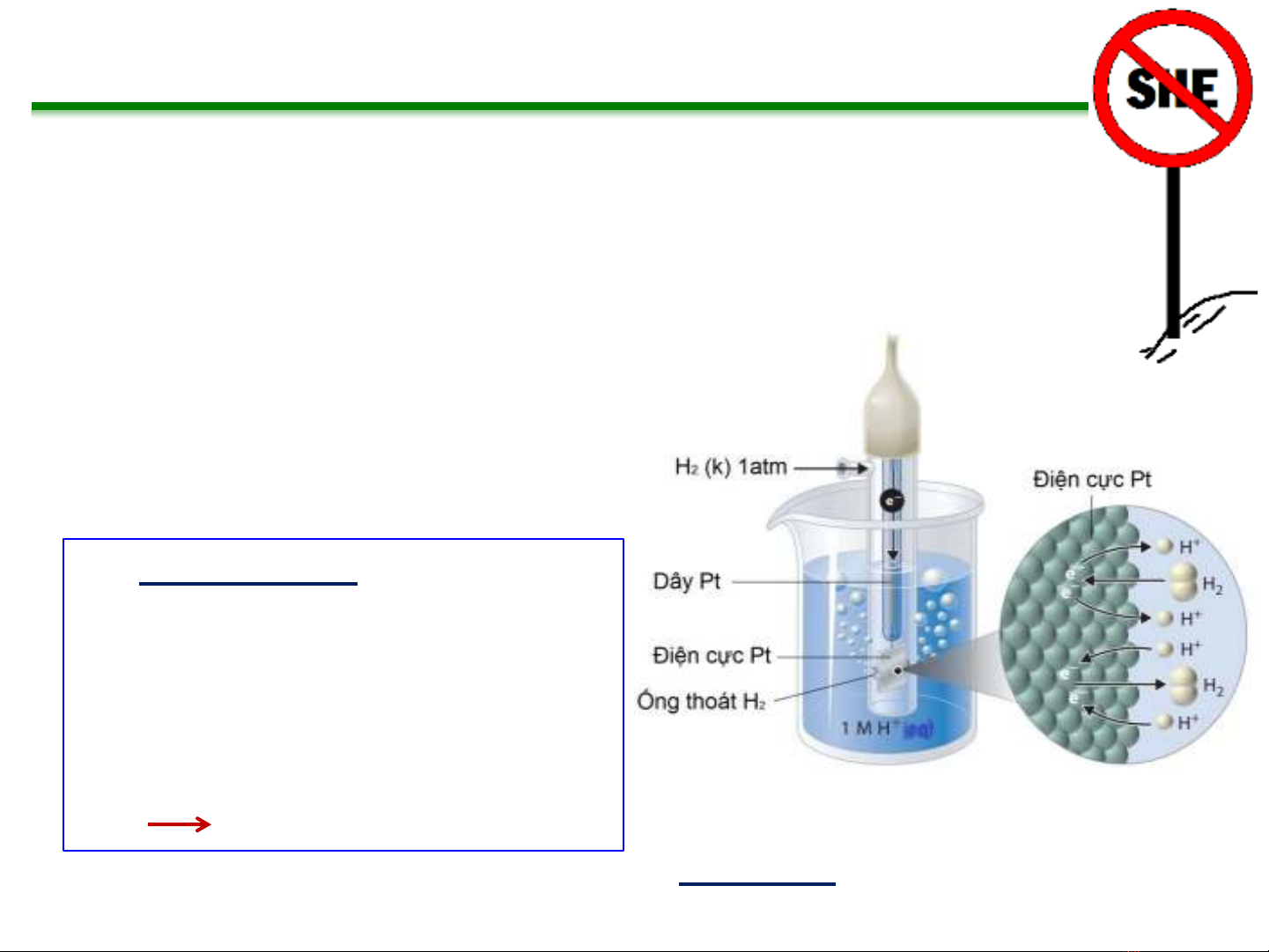
Phản ứng của bán tế bào là:
2H+(n) + 2eÛH2(k)
Bán tế bào điện hóa của điện cực biểu diễn như sau:
Pt(s), H2(k, 1 atm) | H+(n, a = 1.00) ||
Nhược điểm:
oKhó chế tạo và duy trì
oNguy hiểm
oCồng kềnh
Thực tế ít sử dụng
5
Điện cực hydro tiêu chuẩn (SHE)
Ưu điểm ?






![Bài giảng Công nghệ chuyển hóa than: Phần 8 (2) - Văn Đình Sơn Thọ [Full]](https://cdn.tailieu.vn/images/document/thumbnail/2015/20151224/kiepnaybinhyen_04/135x160/4821450944267.jpg)
![Bài giảng Công nghệ chuyển hóa than: Phần 8 (1) - Văn Đình Sơn Thọ [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2015/20151224/kiepnaybinhyen_04/135x160/2751450944269.jpg)


















