
Chương 7 – Điện hóa học
1

Nội dung:
I. Thế điện cực – Sơ đồ pin điện hóa.
II. Thế điện cực chuẩn.
III. Sức điện động của pin (EPIN), rGvà K.
IV. Sự phụ thuộc của thế điện cực vào NỒNG ĐỘ.
V. Sự ăn mòn
VI. Điện phân
VII. Ứng dụng của các quá trình điện hóa
2

3
I. Thế điện cực – Sơ đồ pin điện hóa.
➢Đối tượng nghiên cứu chính của điện hóa chính là các phản ứng oxy hóa
khử.
➢Trong một phản ứng oxy hóa khử,trạng thái oxy hóa của các nguyên tử ở
tác chất THAY ĐỔI.
➢Các thay đổi trong trạng thái oxy hóa là kết quả của quá trình truyền electron
từ một tác chất đến một tác chất khác.
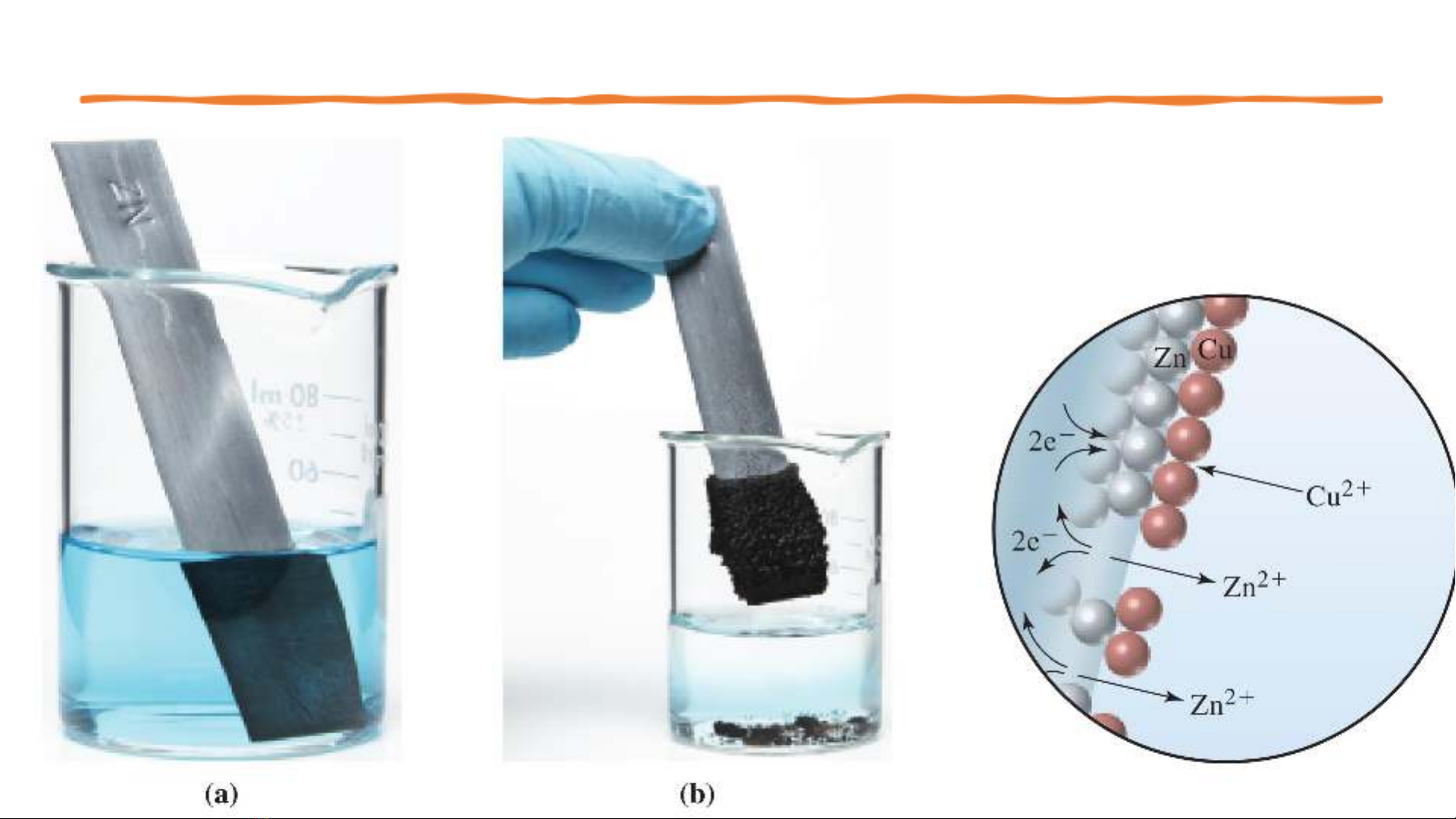
➢Ví dụ:Zn(s) + CuSO4(aq)→Cu(s) + ZnSO4(aq)
Xám bạc Xanh dương Nâu đỏ Không màu
✓Mô tả thí nghiệm:Thanh kẽm được đặt trong dung dịch đồng sulfate.
✓Hiện tượng:Thanh kẽm bị bao phủ bởi kết tủa nâu đỏ của đồng và màu
xanh của dung dịch đồng sulfate nhạt đi.
4
I. Thế điện cực – Sơ đồ pin điện hóa.

5
I. Thế điện cực – Sơ đồ pin điện hóa.
➢Ví dụ:Zn(s) + CuSO4(aq)→Cu(s) + ZnSO4(aq)
Xám bạc Xanh dương Nâu đỏ Không màu
✓Ở mức độ phân tử:
•Các ion Cu2+ (trong dd Đồng sulfate) bị KHỬ để hình thành các nguyên
tử Cu(s) lắng đọng lên bề mặt thanh KẼM.Cu2+(aq)+ 2e−→Cu(s)
•Cùng lúc đó,nguyên tử Zn(s) (từ thanh KẼM) bị OXI HÓA thành ion
Zn2+.Zn(s) →Zn2+(aq)+ 2e−
⇨Sự OXI HÓA của Zn (s) thành Zn2+(aq)và sự KHỬ của Cu2+(aq) thành
Cu(s) (diễn ra ĐỒNG THỜI) liên quan đến việc chuyển 2 electron từ Zn
sang Cu2+.




















![Bộ câu hỏi lý thuyết Vật lý đại cương 2 [chuẩn nhất/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251003/kimphuong1001/135x160/74511759476041.jpg)
![Bài giảng Vật lý đại cương Chương 4 Học viện Kỹ thuật mật mã [Chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250925/kimphuong1001/135x160/46461758790667.jpg)




