
Bài gi ng : V t Li u c khíả ậ ệ ơ
Bài m đ uở ầ : T M QUAN TR NG C A KIM LO I VÀ H P KIMẦ Ọ Ủ Ạ Ợ
* Đ xây d ng và phát tri n n n kinh t qu c dân v ng m nh c n ph i phát tri nể ự ể ề ế ố ữ ạ ầ ả ể
công nghi p n ng , trong đó ngành ch t o c khí là quan tr ng nh t .ệ ặ ế ạ ơ ọ ấ
- Đ ch tao các lo i máy móc thi t b c khí ph i có v t li u , trong đó kim lo iể ế ạ ế ị ơ ả ậ ệ ạ
là v t liêu ch y u . S dĩ kim lo i là v t li u đ c s d ng ch y u c a ngành chậ ủ ế ở ạ ậ ệ ượ ử ụ ủ ế ủ ế
t o c khí b i nó có nhi u tính ch t và u đi m quan tr ng , u vi t h n h n so v i cácạ ơ ở ề ấ ư ể ọ ư ệ ơ ẳ ớ
lo i v t li u khác .ạ ậ ệ
- Ngày nay , ngành công nghi p v t li u phát tri n m nh m v i nhi u lo i v tệ ậ ệ ể ạ ẽ ớ ề ạ ậ
li u khác nhau nh : G , thu tinh , ch t d o , ... V i các tính năng ngày càng t t và s nệ ư ỗ ỷ ấ ẻ ớ ố ả
l ng ngày càng cao , nh ng v n không thay th hoàn toàn đ c cho kim lo i và h pượ ư ẫ ế ượ ạ ợ
kim .
- Do đó , bên c nh vi c nghiên c u thay th các kim lo i và h p kim b ng cácạ ệ ứ ế ạ ợ ằ
v t li u phi kim lo i có tính năng thích ng , ng i ta v n ti p t c nghiên c u đ tìm raậ ệ ạ ứ ườ ẫ ế ụ ứ ể
nh ng kim lo i và h p kim có nh ng tính năng u vi t nh : Nh , b n , ch u ăn mòn ,ữ ạ ợ ữ ư ệ ư ẹ ề ị
ch u nhi t , ch u va đ p , ...ị ệ ị ậ
* Vi c nghiên c u và s n xu t các lo i gang , thép v n là tr ng tâm c a côngệ ứ ả ấ ạ ẫ ọ ủ
nghi p v t li u nói riêng và c a n n kinh t qu c dân nói chung đ i v i t t c các n cệ ậ ệ ủ ề ế ố ố ớ ấ ả ướ
có n n công nghi p phát tri n .ề ệ ể
PH N IẦ
V T LI U KIM LO I VÀ H P KIMẬ Ệ Ạ Ợ
CH NG IƯƠ
NH NG KHÁI NI M C B N V KIM LO IỮ Ệ Ơ Ả Ề Ạ
VÀ H P KIMỢ
I.1: C U T O C A KIM LO I Ấ Ạ Ủ Ạ
I.1.1: Khái ni m v kim lo i .ệ ề ạ
Kim lo i là v t li u sáng d o có th rèn đ c , có tính d n đi n , nhi t cao .ạ ậ ệ ẻ ẻ ượ ẫ ệ ệ
Ph ng di n hóa h c kim lo i là nguyên t d nh ng đi n t trong các ph n ng hóaươ ệ ọ ạ ố ễ ườ ệ ử ả ứ
h c .ọ
I.1.2: Đ c đi m c u t o nguyên t kim lo i .ặ ể ấ ạ ử ạ
Tr ng thái (e) trong nguyên t đ c xác đ nh b i 4 s l ng t :ạ ử ượ ị ở ố ượ ử
n - S l ng t chínhố ượ ử
l - S l ng t qu đ oố ượ ử ỹ ạ
Biên So n : GV L ng Duyên H iạ ươ ả Trang 1
Bài gi ng : V t Li u c khíả ậ ệ ơ
m - S l ng t tố ượ ử ử
ms - S l ng t Spinố ượ ử
Các (e) chuy n đ ng trong nguyên t gi i h n , trong nh ng l p xác đ nh t ngể ộ ử ớ ạ ữ ớ ị ươ
ng v i s l ng t chính .ứ ớ ố ượ ử
n = 1 , 2 , 3 , ... K , L , M , ...
Trong các l p này đ c chia làm nhi u l p con , t ng ng v i s l ng t quớ ượ ề ớ ươ ứ ớ ố ượ ử ỹ
đ o.ạ
l = 0 , 1 , 2 , 3 , ... , (n-1) đ c ký hi u b i các l p : s , p , d , f , ...ượ ệ ở ớ
M i m t tr ng thái (e) trong nguyên t t ng ng v i m t năng l ng xác đ nh .ỗ ộ ạ ử ươ ứ ớ ộ ượ ị
Theo c h c l ng t thì c u hình (e) trong nguyên t đ c c u t o nh sau :ơ ọ ượ ử ấ ử ượ ấ ạ ư
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 ...
Phân l p con :ớs - T i đa 2(e)ố
p - T i đa 6(e)ố
d - T i đa 10(e)ố
f - T i đa 14(e)ố
VD : Al13 : 1s2 2s2 2p6 3s2 3p1
Fe 26 : 1s2 2s2 2p6 3s2 3p6 4s2
C6 : 1s2 2s2 2p2
T c u hình trên ta rút ra là các l p ngoài cùng có liên k t y u nên d gây ra ph nừ ấ ớ ế ế ể ả
ng hóa h c .ứ ọ
I.1.3: Liên k t kim lo i .ế ạ
Kim lo i có c u tao m ng tinh th liên k t trong kim lo i đ c g i là liên k tạ ấ ạ ể ế ở ạ ượ ọ ế
kim lo i .ạ
Liên k t kim lo i đ c mô t nh sau : các nút l i là cá ion (+) , kim lo iế ạ ượ ả ư Ở ướ ạ
trong kho ng không gi a nút l i là các (e) t do tao thành khí đi n t . Liên k t kimả ữ ướ ự ệ ử ế
lo i t o thành do l c hút gi a màng các ion (+) v i khí (e) . Do v y mà kim lo i có tínhạ ạ ự ữ ớ ậ ạ
d o .ẻ
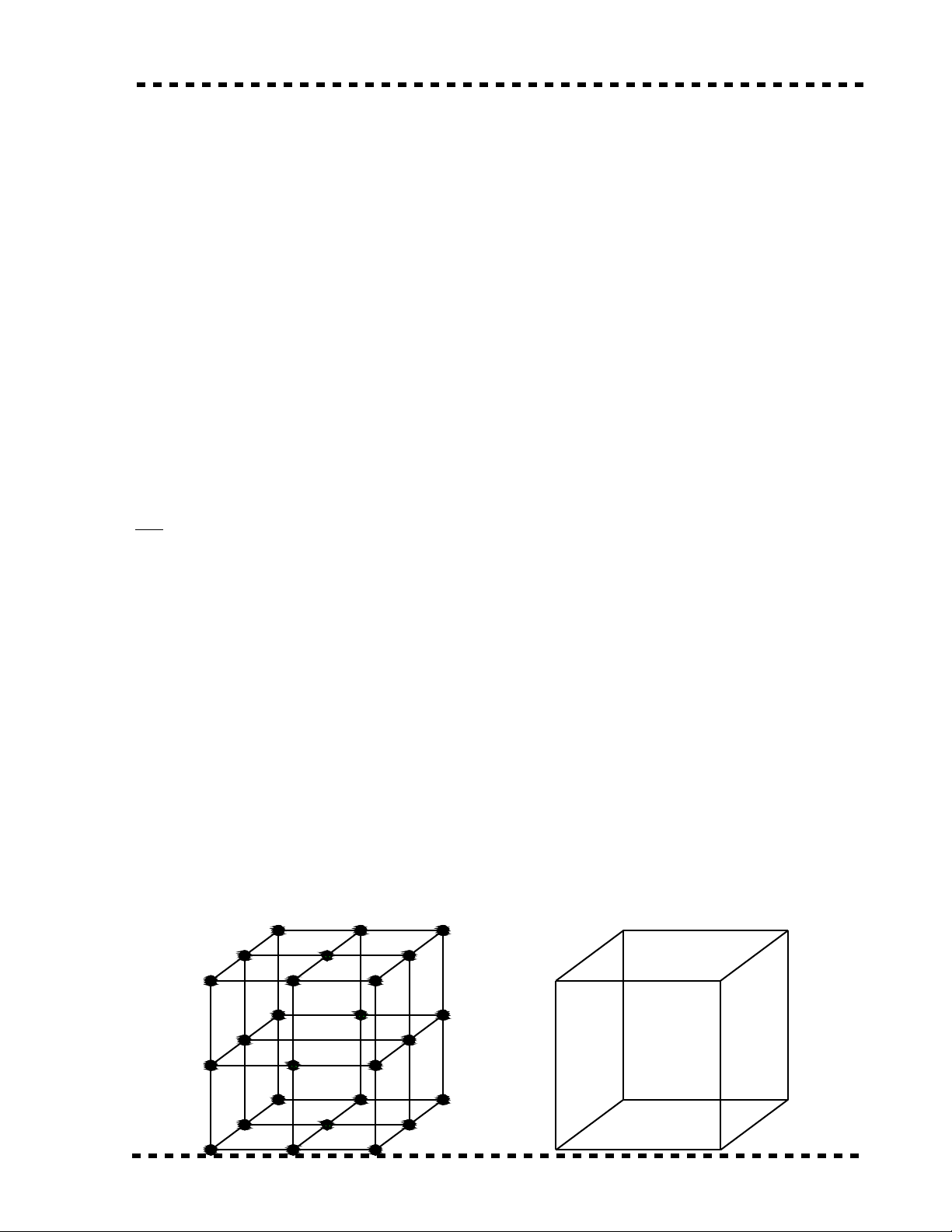
I.1.4: C u t o m ng tinh th kim lo i .ấ ạ ạ ể ạ
a - M ng tinh th và ô c b n .ạ ể ơ ả
Biên So n : GV L ng Duyên H iạ ươ ả Trang 2
Bài gi ng : V t Li u c khíả ậ ệ ơ
- Trong kim lo i các kim lo i đ c s p x p m t cách tr t t tu n hoàn trongạ ạ ượ ắ ế ộ ậ ự ầ
không gian .
- Các nguyên t trong kim lo i đ c s p x p m t cách có tr t t các nguyên tử ạ ượ ắ ế ộ ậ ự ử
đ u n m trên m t ph ng song song cách đ u g i là m t tinh th , t p h p vô s nh ngề ằ ặ ẳ ề ọ ặ ể ậ ợ ố ữ
m t tinh th nh th nó l p thành m ng tinh th .ặ ể ư ế ậ ạ ể
- Toàn b m ng không gian có th xem nh đ c t o thành nh ng hình kh i nhộ ạ ể ư ượ ạ ữ ố ỏ
nh t đ n gi n gi ng nhau mà cách s p x p các phân t là đ i di n chung cho toàn m ngấ ơ ả ố ắ ế ử ạ ệ ạ
nh ng ô nh v y g i là ô c b n .ữ ư ậ ọ ơ ả
b - Các ki u m ng tinh th th ng g p .ề ạ ể ườ ặ
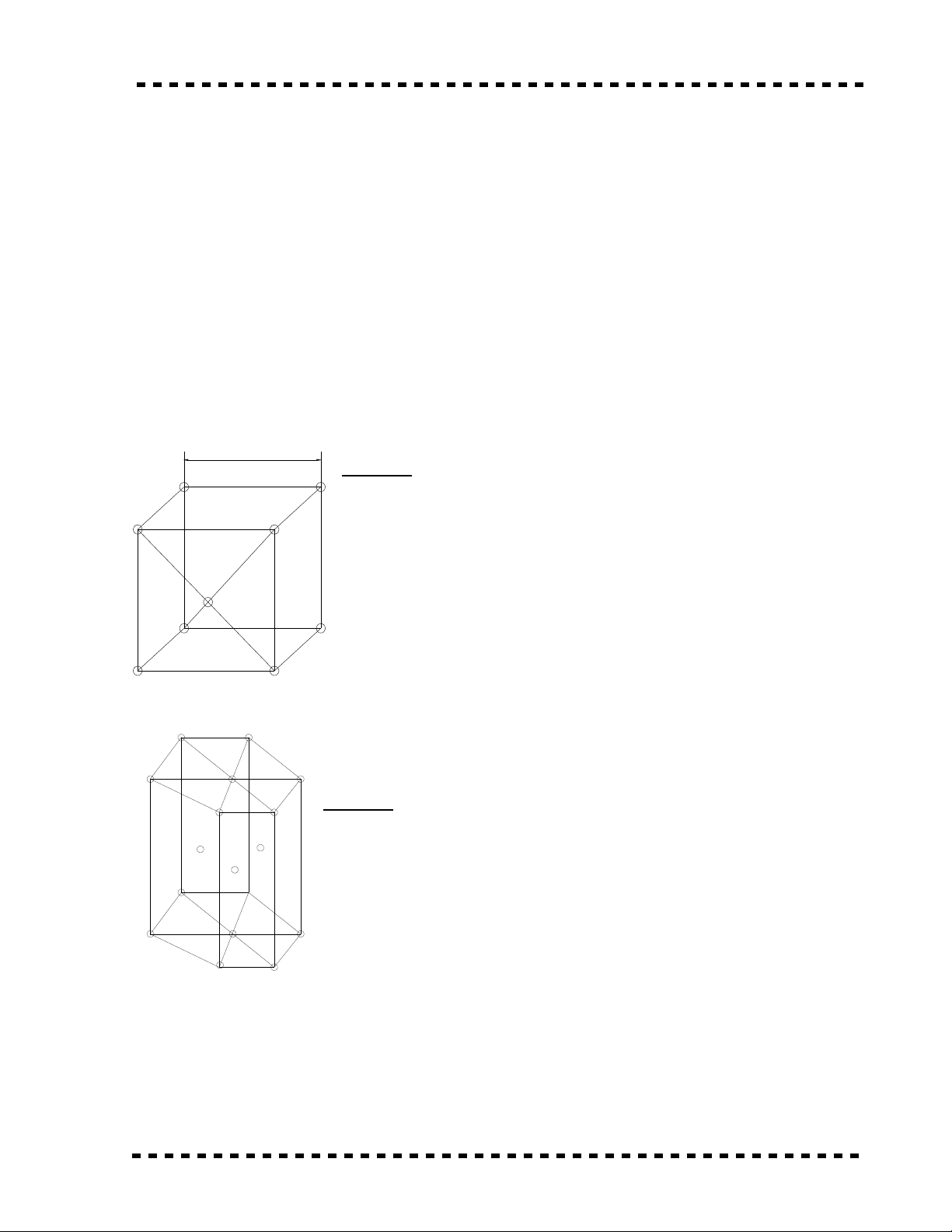
* L p ph ng th tâm .ậ ươ ể
C u t o : Trong các ô c b n ki u m ng này có các nguyên tấ ạ ơ ả ể ạ ử
n m các nút (đ nh) c a hình l p ph ng và gi a m i hìnhằ ở ỉ ủ ậ ươ ở ữ ỗ
l p ph ng có m t nguyên t .ậ ươ ộ ử
- Kho ng cách a gi a tâm các nguyên t k nhau c a ô cả ữ ử ề ủ ơ
b n m ng tinh th , g i là thông s m ng . Đ l n đo b ng Aả ạ ể ọ ố ạ ộ ớ ằ o
( Ángtrong ) 1Ao = 10-8 cm .
- Các kim lo i có ki u m ng này : Feạ ể ạ , Cr , Mo , W , ...
* L c ph ng dày đ c .ụ ươ ặ
C u t o : Trong các ô c b n ki u m ng này có các nguyên tấ ạ ơ ả ể ạ ử
n m các nút (đ nh) c a hình l c lăng hai nguyên t n m trungằ ở ỉ ủ ụ ử ằ ở
tâm hai m t đáy và ba nguyên t n m trung tâm c a ba kh iặ ử ằ ở ủ ố
lăng tr tam giác .ụ
- Các kim lo i có ki u m ng này : Znạ ể ạ , Cu , Mg , ...
* S bi n đ i m ng tinh th c a kim lo i .ự ế ổ ạ ể ủ ạ
tr ng thái r n khi đi u ki n ngoài tr i thay đ i ( áp su t , nhi t đ .v.v..) tỞ ạ ắ ề ệ ờ ổ ấ ệ ộ ổ
ch c kim lo i thay đ i theo . Nghĩa là d ng ô c b n thay đ i ho c thông s m ng cóứ ạ ổ ạ ơ ả ổ ặ ố ạ
giá tr thay đ i ng i ta g i đó là s bi n đ i m ng tinh th .ị ổ ườ ọ ự ế ổ ạ ể
Biên So n : GV L ng Duyên H iạ ươ ả Trang 3
a
Bài gi ng : V t Li u c khíả ậ ệ ơ
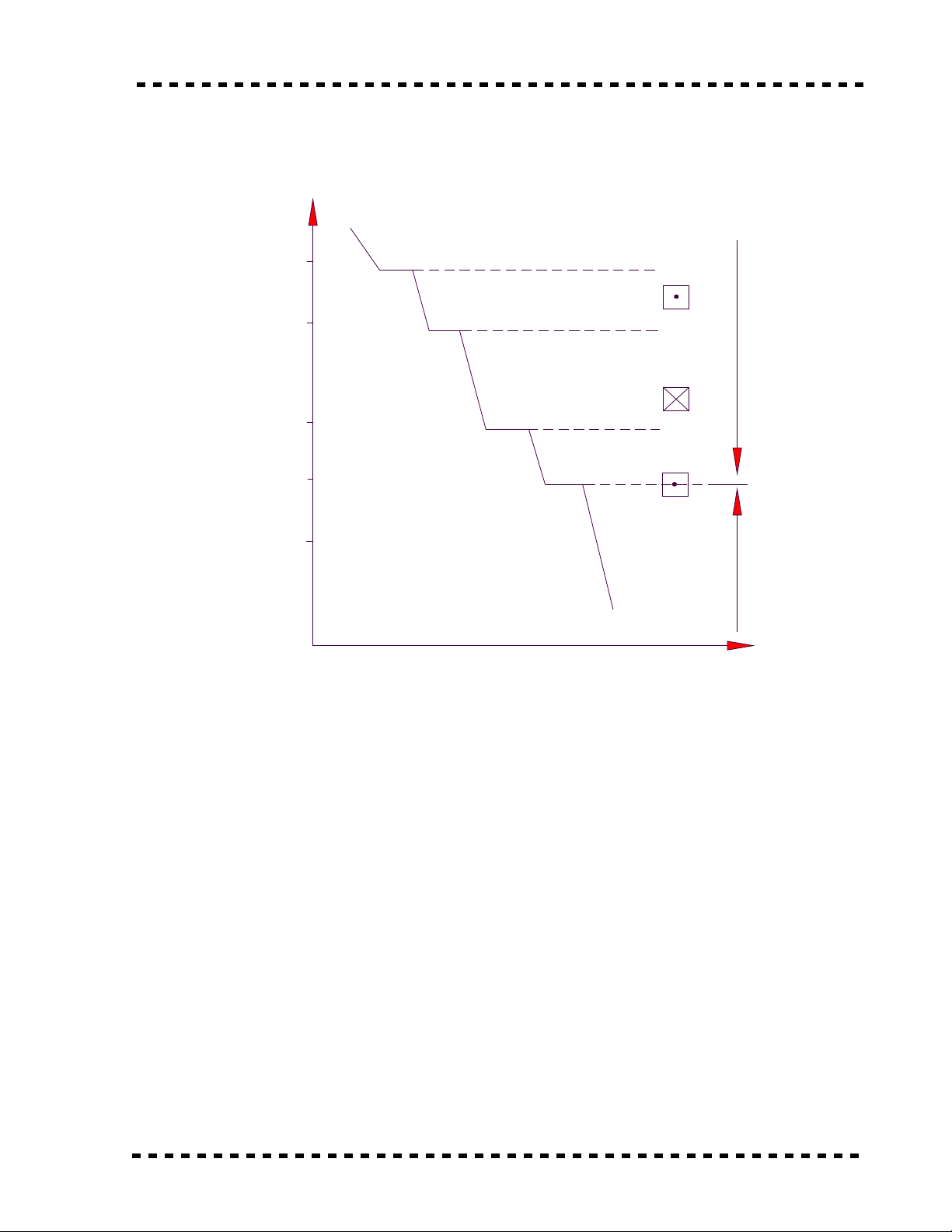
Ví d : S chuy n bi n thù hình c a s t . ụ ự ể ế ủ ắ
I.2: C UẤ T OẠ
C A H PỦ Ợ KIM
Trong th c tự ế
kim lo iạ nguyên
ch t r t ítấ ấ dùng , độ
b n th pề ấ kh năngả
ng d ngứ ụ không cao .
Nên ph iả dùng t iớ
thép h p kimợ .
I.2.1: Khái ni mệ
chung .
a - Đ nh nghĩa .ị
H p kim là m t d ng v t ch t có tính kim lo i nh n bi t đ c b ng cách n uợ ộ ạ ậ ấ ạ ậ ế ượ ằ ấ
ch y hay liên k t m t kim lo i v i m t hay nhi u các nguyên t khác .ả ế ộ ạ ớ ộ ề ố
Thành ph n c a h p kim đ c bi u di n b ng ầ ủ ợ ượ ể ễ ằ o/o tr ng l ng .ọ ượ
b - Pha , h th ng (h ) , nguyên .ệ ố ệ
* Pha : Là m t t ph n đ ng nh t c a h p kim h th ng chúng có thành ph nộ ổ ầ ồ ấ ủ ợ ệ ố ầ
đ ng nh t cùng tr ng thái nh : l ng cùng l ng , r n cùng r n , ... nh ng ph i cùng ki uồ ấ ạ ư ỏ ỏ ắ ắ ư ả ể
m ng . Chúng ngăn cách nhau b ng b m t phân chia .ả ằ ề ặ
* H th ng (h ) : ệ ố ệ T p h p các pha tr ng thái cân b ng .ậ ợ ở ạ ằ
* Nguyên : Là nh ng thành ph n đ c l p t o nên các pha c a (H ) .ữ ầ ộ ậ ạ ủ ệ
I.2.2: C u t o c a h p kim .ấ ạ ủ ợ
a - Dung d ch đ c .ị ặ
H p kim có c u t o là dung d ch đ c khi nguyên t c a các nguyên t thành ph nợ ấ ạ ị ặ ử ủ ố ầ
có kích th c g n gi ng nhau . Khi k t tinh , các h p kim này t o thành các m ng tinhướ ầ ố ế ợ ạ ạ
th trong đó có nguyên t c a các nguyên t thành ph n .ể ử ủ ố ầ
Biên So n : GV L ng Duyên H iạ ươ ả Trang 4
T C
Loíng
o
o
ooo
o
oo
o
oo
Khäng coï tæì tênh
Coï tæì tênh
t ( thåìi gian )
Så âäö biãún âäøi maûng tinh thãø cuía sàõt ( Fe )
500
800
1000
1400
1600 1539
1392
910
768
LPTT
Fe
α
0 − 910
LPDT Fe
γ
910 - 1392
LPTT Fe
δ
1392 − 1539
Bài gi ng : V t Li u c khíả ậ ệ ơ
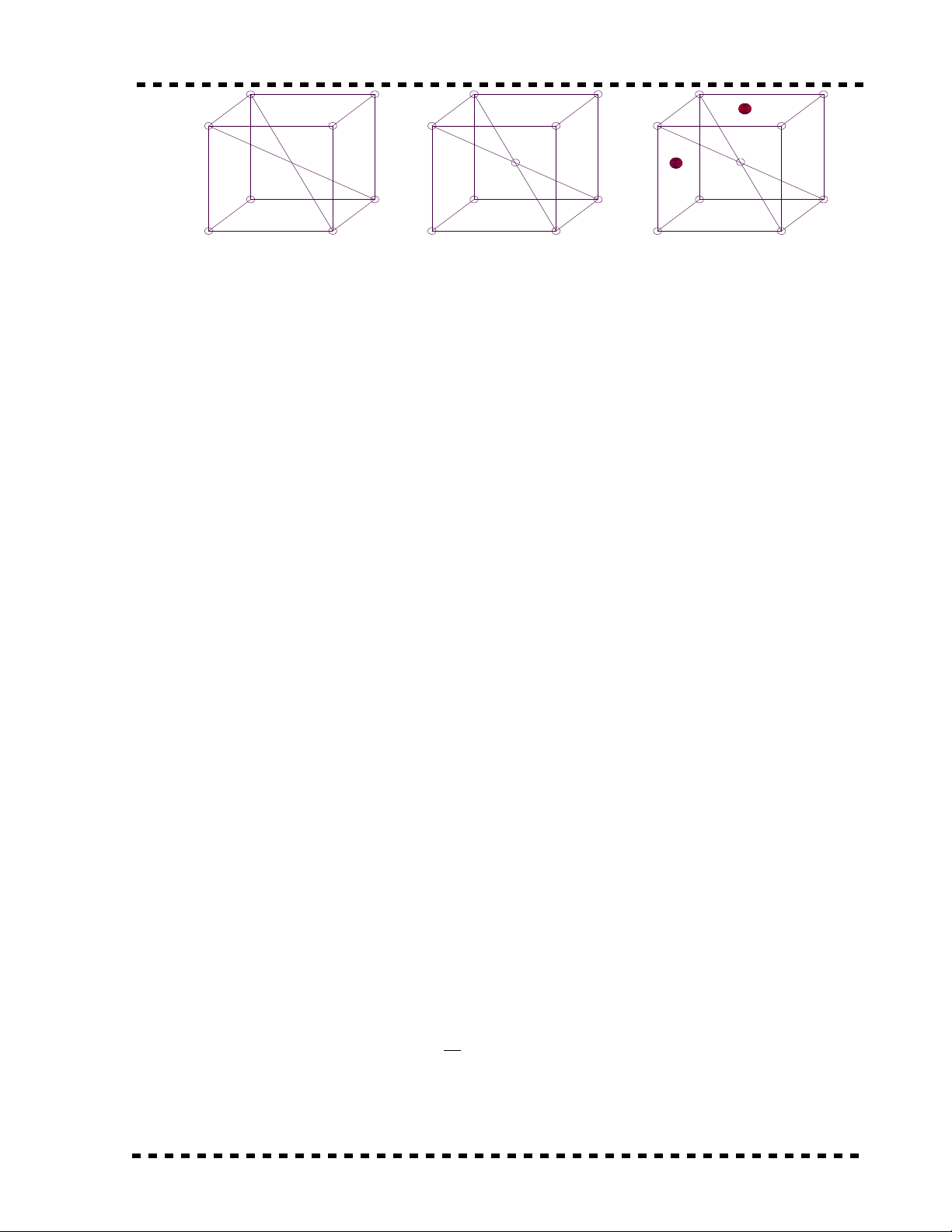
abc
a - M ng tinh th c a s t thay thạ ể ủ ắ ế
b - M ng tinh th c a dung d ch đ c thay thạ ể ủ ị ặ ế
c - M ng tinh th c a dung d ch đ c xen kạ ể ủ ị ặ ẽ
Có hai lo i dung d ch đ c :ạ ị ặ
* Dung d ch đ c thay th : ( Hb )ị ặ ế
Ví d : Cu và Ni : Nguyên t Ni đ y m t s nguyên t Cu ra kh i nút m ng tinh th vàụ ử ẩ ộ ố ử ỏ ạ ể
thay th vào v trí đó .ế ị
* Dung d ch đ c xen k : ( Hc )ị ặ ẽ
Nguyên t c a các nguyên t hoà tan .ử ủ ố
Ví d : C , Oụ2 , Bo , ... N m gi a xen k vào nh ng l h ng c a gi a các nút m ng tinhằ ữ ẽ ữ ỗ ổ ủ ữ ạ
th c a nguyên t kim lo i c b n (dung môi) .ể ủ ố ạ ơ ả
b - H p ch t hóa h c .ợ ấ ọ
H p ch t có c u t o là h p ch t hóa h c , khi nguyên t c a các nguyên t khácợ ấ ấ ạ ợ ấ ọ ử ủ ố
nhau , tác d ng hóa h c v i nhau theo t l chính xác gi a các nguyên t có ki u m ngụ ọ ớ ỉ ệ ữ ử ể ạ
nh t đ nh và có thành ph n hóa h c xác đ nh bi u di n b ng m t công th c hóa h c .ấ ị ầ ọ ị ể ễ ằ ộ ứ ọ
Ví d : H p ch t c a Fe và C : Feụ ợ ấ ủ 3 C ( Cacbit s t )ắ
c - H n h p c h c .ỗ ợ ơ ọ
H p kim có c u t o là h n h p c h c khi nguyên t c a các nguyên t thànhợ ấ ạ ỗ ợ ơ ọ ử ủ ố
ph n khác nhau v kích th c và m ng tinh th .ầ ề ướ ạ ể
I.3: TÍNH CH T CHUNG C A KIM LO I VÀ H P KIMẤ Ủ Ạ Ợ
I.3.1: Tính ch t v t lý .ấ ậ
a. V sáng m t ngoài :ẻ ặ Chia ra làm 2 lo i : Kim lo i màu và kim lo i đenạ ạ ạ
- Kim lo i màu và h p kim đen : Là Fe và h p kim c a Fe v i C ( thép , gang ).ạ ợ ợ ủ ớ
- Kim lo i màu và h p kim màu : Là t t c các kim lo i và h p kim còn l i.ạ ợ ấ ả ạ ợ ạ
b. Kh i l ng riêng :ố ượ Là s đo kh i l ng v t ch t ch a trong m t đ n v thố ố ượ ậ ấ ứ ộ ơ ị ể
tích c a v t th .ủ ậ ể
)(Kg/m
V
m
γ3
=
Trong đó : m - Kh i l ng c a v t th ( Kg )ố ượ ủ ậ ể
V - Th tích c a v t th ( mể ủ ậ ể 3 )
Biên So n : GV L ng Duyên H iạ ươ ả Trang 5

![Bài giảng Khoa học vật liệu cơ khí [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251231/kimphuong1001/135x160/35861767942305.jpg)









![Giáo trình Vật liệu cơ khí [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250909/oursky06/135x160/39741768921429.jpg)














