4/6/2011
1
CHƯƠNG VII.
CÔNG NGHỆ DI TRUYỀN
THỰC VẬT
Quá trình chọn lọc tự nhiên
•Trao đổi vật liệu di truyền tạo ra
những tính trạng mong muốn gia
tăng sản lượng cây trồng.
•Tính trạng chỉ được tạo ra từ những
dòng hữu thụ.
•Không loại trừ được những tính trạng
không mong muốn.
Kỹ thuật tái tổ hợp DNA
•Giải quyết được những vấn đề trong
chương trình tạo giống cổ điển.
•Nhờ xác định và dòng hóa những gene
chuyên biệt cho tính trạng mong muốn
VD: tính trạng chịu rét, chịu mặn, kháng
thuốc diệt cỏ, chín chậm, …
Overview genetic engineering
Kỹ thuật tái tổ hợp DNA
•Mục đích thay đổi di truyền
•Nguồn, chức năng và khả năng tiếp hợp
bền vững của gene chuyển
•Phân tích thành phần thực phẩm (hàm
lượng dinh dưỡng, độc tố tích lũy,…)
Kỹ thuật tái tổ hợp DNA
•Cây trồng chuyển gene thương mại đầu
tiên: FLAVRSAVR tomato (Calgene
Inc. )
•Ức chế gene tạo enzyme polygalactu-
ronase (PG) phân hủy pectin nhờ
chuyển antisense gene
Dòng hóa gene đích
•Nguồn gene đích có thể là DNA nhiễm
sắc thể hay cDNA từ mRNA
•Enzyme công cụ
•Vector tạo dòng
4/6/2011
2
Các enzyme công cụ
•Restriction
enzymes
(Enzyme cắt
giới hạn)
•Ligase
(Enzyme nối)
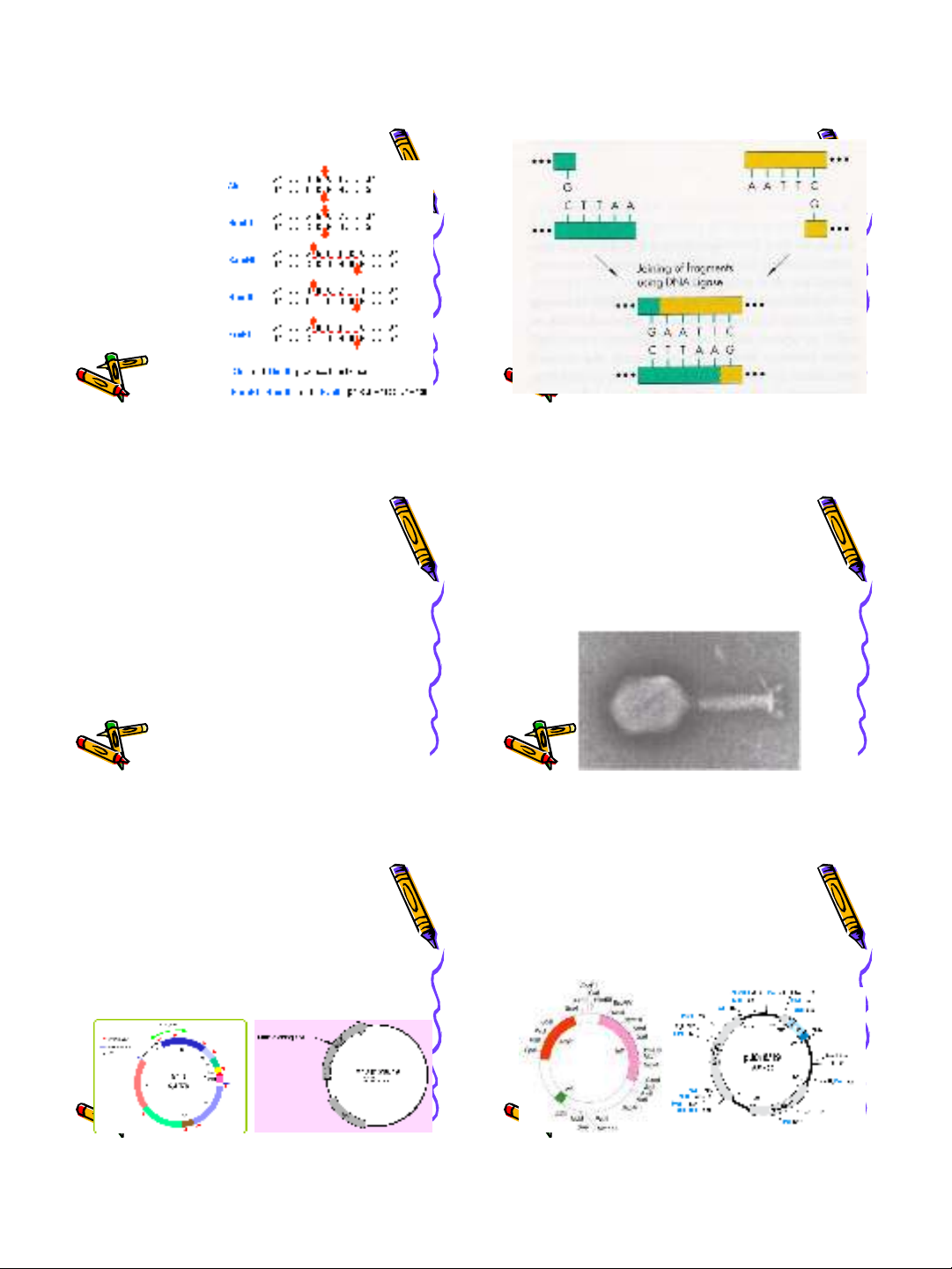
Cho trình tự DNA:
5’… CCTAGATCTTTAACC…TAGATCTAA…3’
3’…GGATCTAGAAATTGG…ATCTAGATT…5’
A) Xử lý DNA trên với enzyme giới hạn
BgIII (A/GATCT). Sẽ thu được mấy đoạn
DNA trong 2 trường hợp DNA đã cho là
mạch thẳng và mạch vòng. Vẽ các đoạn
DNA được phóng thích (nếu có)
B) Có thể xen đoạn DNA được phóng thích
vào vector được cắt bởi enzyme BamHI
(G/GATCC) hay không? Vẽ hình minh họa
Các vector tạo dòng
Phage λ:
•DNA sợi đôi thẳng
•Kích thước: 48,5 kb
•Chèn DNA có kích thước 18-25 kb
Electron micrograph of bacterial
phage from the host
E. coli
Các vector tạo dòng
Phage M13:
•DNA sợi đơn vòng
•Kích thước: 6,4 kb
•Nhiều dạng biến đổi của M13 có mang
các polylinker (hay MCS)
Các vector tạo dòng
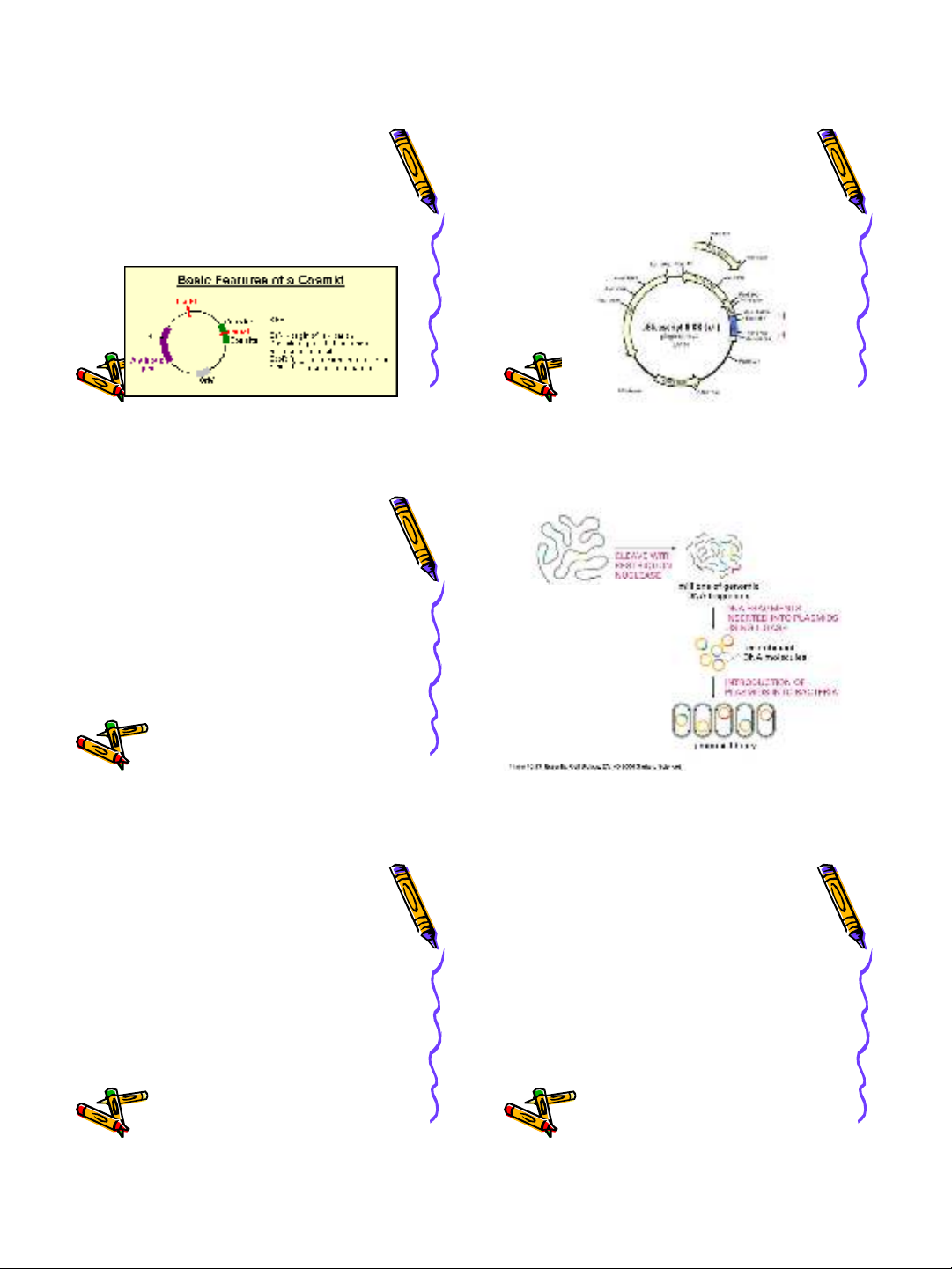
Plasmid:
•DNA vòng sợi kép, nằm ngoài NST VK
•Chèn DNA có kích thước 18-25 kb
pBR322
pBR322
4361 bp
pBR322
4361 bp
4/6/2011
3
Các vector tạo dòng
Cosmid:
•Là vector plasmid chứa gene
cos
của
phage λ Tái bản giống plasmid
•Chèn được đoạn DNA lớn (35-45 kb)
Các vector tạo dòng
Phagemid:
•Là sự kết hợp giữa phage M13 với
plasmid
Tạo plasmid tái tổ hợp
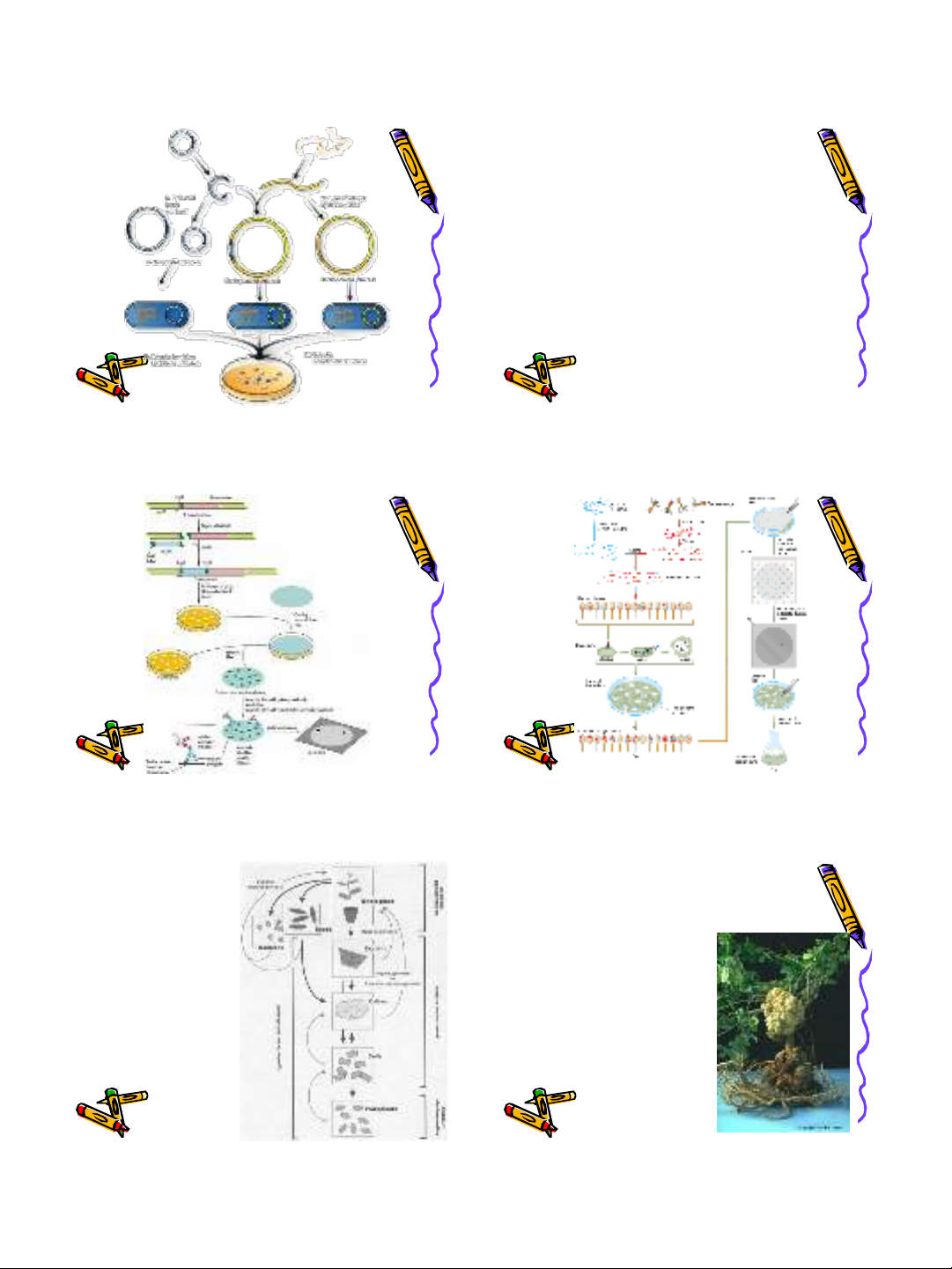
Xây dựng DNA library
•Việc lựa chọn DNA hay cDNA phụ
thuộc vào tính trạng mong muốn
chuyên biệt và vào hệ phương pháp
•Tập hợp những đoạn DNA hay cDNA
được gắn vào vector thích hợp
(plasmid hay phage)
•Chuyển vector vào vi khuẩn để nhân số
lượng và chọn lọc DNA library
Xây dựng
DNA library
Sàng lọc gene mục tiêu
1. Chọn lọc:
•Vector mang gene kháng kháng sinh
(tetracyclin, penicillin hay ampicillin)
•Chỉ có dòng nào chứa vector mới sống
được trên môi trường chọn lọc có chứa
chất kháng sinh
Sàng lọc gene mục tiêu
2. Sàng lọc:
•Gene lacZ’ sản xuất β-galactosidase
thủy giải X-gal tạo sản phẩm có màu
xanh lam
•Nếu có DNA gắn xen vào lacZ’ mất
khả năng thủy phân X-gal khuẩn lạc
không có màu xanh
4/6/2011
4
Xây dựng DNA library
Sàng lọc gene mục tiêu
3. Xác định gene đích:
•Chuyển vi khuẩn lên giấy lọc
•Rửa giấy lọc với dung dịch làm biến
tính DNA có chứa các probe đánh dấu
phóng xạ
•Tìm vết phóng xạ
•So sánh với đĩa Petri ban đầu
Screening DNA library
Các phương pháp
chuyển gene:
•Gián tiếp qua
Agrobacterium
•
Tr
ự
c ti
ế
p: PEG,
xung đi
ệ
n, b
ắ
n
gene
Chuyển gene gián tiếp nhờ
Agrobacterium
•
Agrobacterium
sống
lân cận hay ngay
trên bộ rễ xuyên
qua các vết thương
tổ chức tế bào
thực vật phát sinh
bướu
4/6/2011
5
Chuyển gene gián tiếp nhờ
Agrobacterium
•Tác nhân gây tạo bướu là Plasmid Ti của
vi khuẩn
Chuyển gene gián tiếp nhờ
Agrobacterium
•Gene tạo bướu nằm trên đoạn T-DNA
•Sự di chuyển của T-DNA vào tế bào
thực vật chịu sự quy định của gene
vir
Chuyển gene gián tiếp nhờ
Agrobacterium
•Loại bỏ các gen gây khối u và gen mã hoá opine
của T-DNA và thay thế vào đó là các marker
chọn lọc. Gen chuyển được xen vào giữa các
vùng bờ của T-DNA.
Chuyển gene gián tiếp nhờ
Agrobacterium
•Khi DNA vi khuẩn được hợp nhất với
nhiễm sắc thể thực vật, nó sẽ tấn công
vào hệ thống tổ chức của tế bào một
cách có hiệu quả và sử dụng nó để đảm
bảo cho sự sinh sôi của quần thể vi
khuẩn.
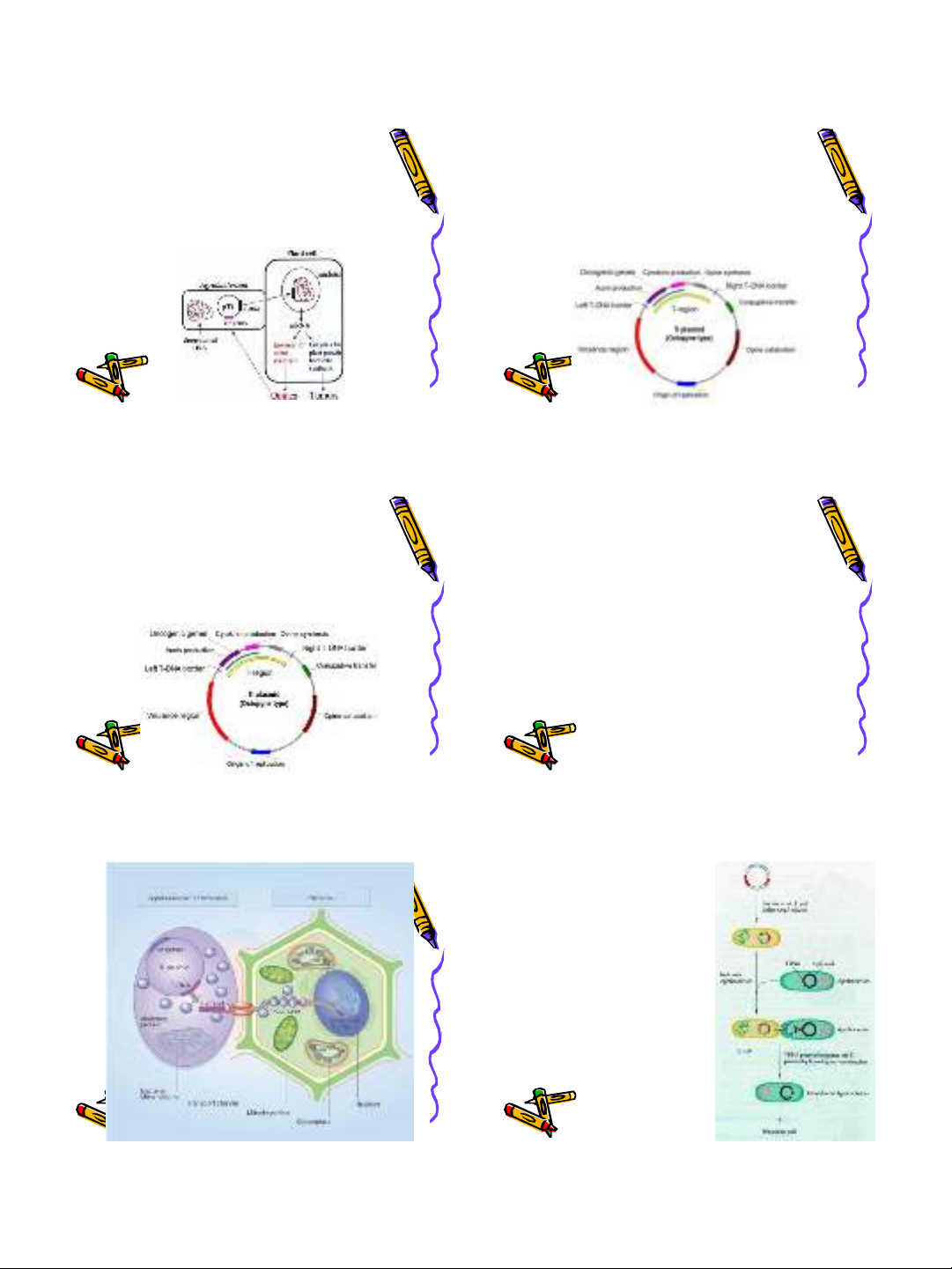
Chuẩn bị
Agrobacterium
mang plasmid Ti chứa
gene đích:
•Sàng lọc
E.coli
chứa
gene đích
•Tiếp hợp giữa
E.coli
và
Agrobacterium
•Tái tổ hợp tương đồng
giữa 2 plasmid















![Bài giảng Giáp xác chân mái chèo [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250927/lethihongthuy2402@gmail.com/135x160/92891759114976.jpg)



![Tài liệu học tập Chuyên đề tế bào [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250906/huutuan0/135x160/56151757299182.jpg)






