
Trường THPT Hà Huy Tập
KIỂM TRA THƯỜNG XUYÊN (LẦN 1) – HÓA 10. NĂM HỌC: 2024 - 2025
Họ và tên:……………………………………………………..Lớp:……….
PHẦN 1. TRẮC NGHIỆM NHIỀU PHƯƠNG ÁN LỰA CHỌN (Mỗi câu chỉ chọn
1 phương án)
Câu 1. Một nguyên tử X có tổng điện tích âm ở lớp vỏ là -30,438.10-19C. Số electron có
trong lớp vỏ nguyên tử X là A. 19. B. 7. C. 8. D. 10.
Câu 2. Trường hợp nào sau đây có sự tương ứng giữa hạt cơ bản với khối lượng và điện
tích của chúng?
A. Electron, m ≈0,00055 amu, q = -1. B. Proton, m ≈1 amu, q = -1.
C. Neutron, m ≈1 amu, q = +1. D. Proton, m ≈1 amu, q = 0.
Câu 3. X được dùng làm chất bán dẫn trong kĩ thuật vô tuyến điện, chế tạo pin Mặt Trời.
Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình
electron của nguyên tử X là:
A. 1s22s22p5.B. 1s22s22p63s23p2.C. 1s22s22p63s23p4.D. 1s22s22p6.
Câu 4. Copper có 2 đồng vị 63Cu, 65Cu và oxygen có 3 đồng vị 16O, 17O, 18O. Số loại
phân tử CuO có thể được tạo thành là bao nhiêu?
A. 6. B. 9. C. 12. D. 18.
Câu 5. Cặp nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học ?
A.
G
14
7
;
M
16
8
.B.
L
16
8
;
D
22
11
.C.
E
15
7
;
Q
22
10
.D.
M
16
8
;
L
17
8
.
Câu 6. Số N trong nguyên tử của một nguyên tố hoá học có thể tính được khi biết số
khối A, số thứ tự của nguyên tố (Z ) theo công thức:
A. A = Z – N. B. N = A – Z. C. A = N – Z. D. Z = N + A.
Câu 7. Chọn phát biểu đúng?
A. Số orbital tối đa trong lớp M là 8.
B. Phân lớp 4s có mức năng lượng thấp hơn phân lớp 3d.
C. Lớp electron thứ 3 (lớp M) có 3 phân lớp.
D. Lớp thứ 4 có tối đa 32 eletron.
Câu 8. Nguyên tử X có 17 proton trong hạt nhân và số khối bằng 37. Kí hiệu nguyên tử
của X là A.
37
20 X
.B.
20
17 X
.C.
17
37 X
.D.
37
17 X
.
Câu 9. Các hạt cấu tạo nên hầu hết các nguyên tử là
A. electron, proton và neutron B. proton và neutron.
C. neutron và electron. D. electron và neutron.
Câu 10. Trong nguyên tử
86
37 Rb
có tổng số hạt proton và neutron là
A. 49. B. 123. C. 37. D. 86.
Câu 11. Orbital s có dạng
A. hình tròn. B. hình số tám nổi. C. hình cầu. D. hình bầu dục.
Câu 12. Trong các nguyên tử N (Z = 7), O (Z = 8), F (Z = 9) và C (Z = 6). Nguyên tử có
ít electron độc thân nhất là
A. O (Z = 8). B. F (Z = 9). C. N (Z = 7). D. C (Z = 6).
PHẦN II. TRẮC NGHIỆM ĐÚNG SAI (Trong mỗi ý a), b), c), d) ở mỗi câu, HS
chọn đúng hoặc sai)
Câu 1. Nguyên tử X có tổng hạt proton, neutron và electron là 46. Trong hạt nhân
nguyên tử X hạt không mang điện nhiều hơn hạt mang điện là 1. Chọn phát biểu sai về
X? A. Tổng hạt trong hạt nhân X là 31.
B. Nguyên tử X có 20 hạt không mang điện.
C. Số hiệu nguyên tử của X là 16.
D. Trong nguyên tử X, tổng hạt mang điện nhiều hơn hạt không mang điện là 14.
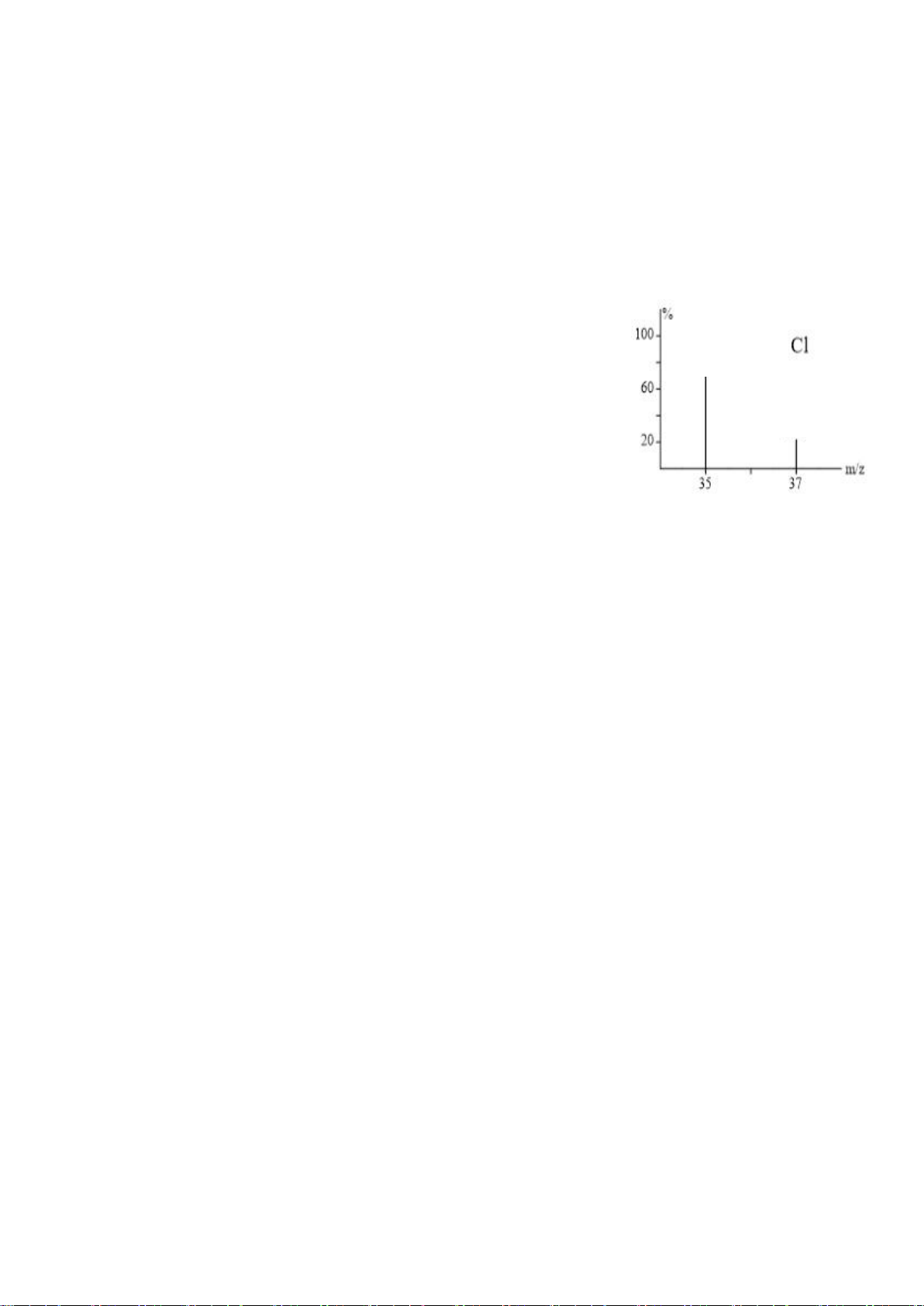
Câu 2. Chlorine có hai đồng vị
37
17
Cl (chiếm 24,23%) và
35
17
Cl.
a. Phổ khối lượng của Chlorine tương ứng như hình bên
b. Nguyên tử khối trung bình của Chlorine là 35,48 amu.
c. Cả hai đồng vị đều có số neutron nhiều hơn số proton 1
hạt.
d. Thành phần % theo khối lượng của
35
17
Cl trong CaCl2là
23,9%. (cho Ca=40)
Câu 3. Cho các phát biểu về n
guyên tử
52
24 X
a.
X có số hạt proton nhiều hơn neutron là 4.
b.
X có tổng các hạt mang điện nhiều hơn số hạt không mang điện là 20.
c.
X có 4 lớp electron và có 3 electron độc thân.
d.
X có số electron ở lớp ngoài cùng bằng số electron ở mức năng lượng cao nhất.
PHẦN III. TỰ LUẬN
Viết cấu hình electron nguyên tử, xác định số electron độc thân, tính chất cơ bản (KL,
PK, KH) khi biết:
a. Z = 9 b. Z = 22 c. Có tổng số electron ở phân lớp p là 9.
d. Có 4 lớp electron và có tổng số electron ở phân lớp p gấp bốn lần số electron ở mức
năng lượng cao nhất. ------ HẾT ------
75,77%
24,23%


























