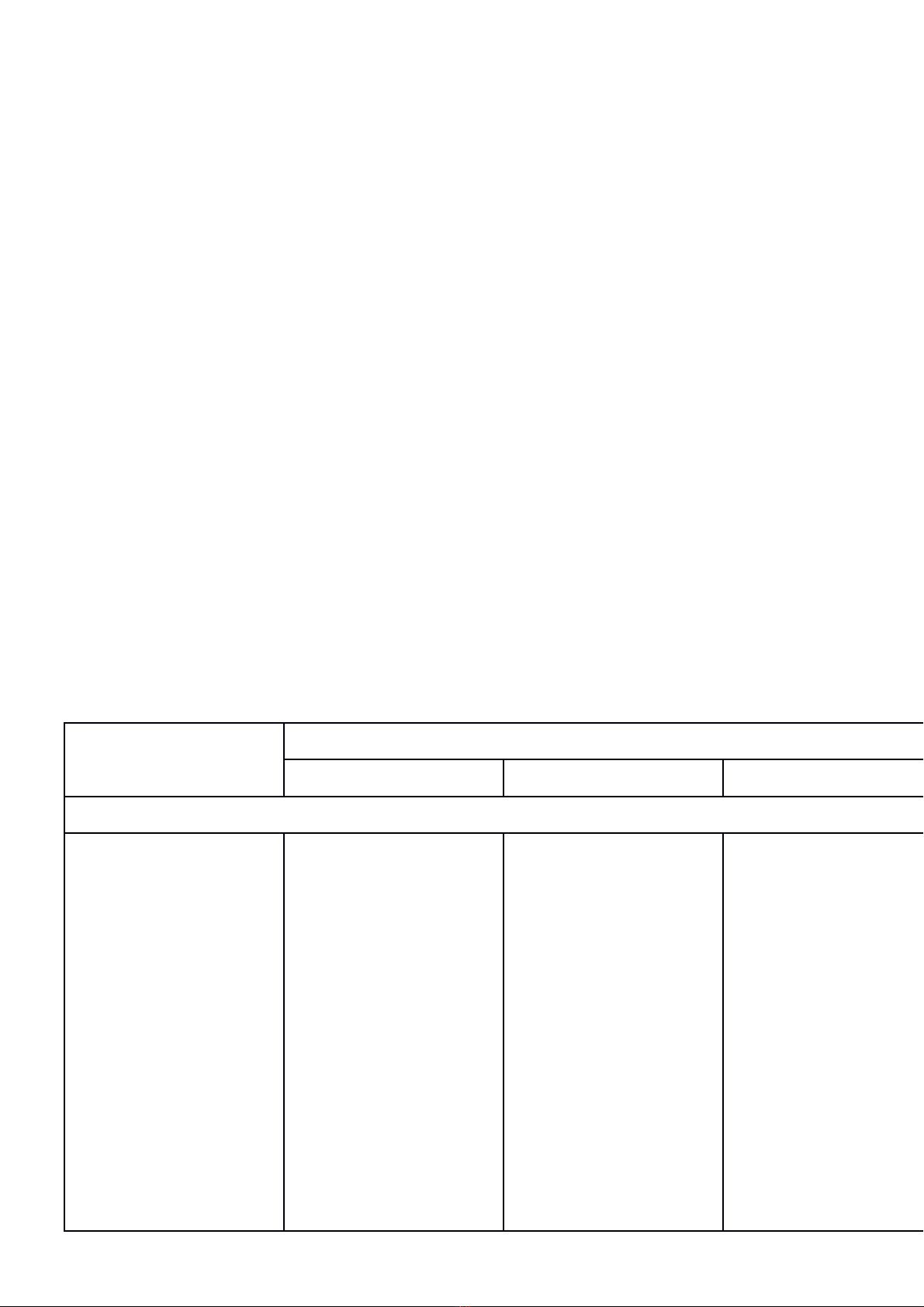
Trường THCS Lý Thường Kiệt KIỂM TRA GIỮA HỌC KỲ II (2023-2024)
Họ và tên:……………………………… …….. MÔN: HÓA HỌC 9
Lớp: ………… Thời gian: 45 phút
Điểm Lời phê của giáo viên
I. TRẮC NGHIỆM (3,0 điểm)
Câu 1. Dãy các hợp chất nào sau đây là hợp chất hữu cơ ?
A. CH4, C2H6, CO. B. C2H4, CH4, C2H5OH.
C. CH4, C2H2, CO2. D. C2H2, C2H6O, BaCO3.
Câu 2. Nhóm gồm các chất đều khử được CuO ở nhiệt độ cao là
A. CO, C. B. Cl2, CO2. C. CO, CO2. D. H2O, C.
Câu 3. Dãy gồm các nguyên tố phi kim là
A. C, S, O, Na. B. Cl, C, P, S. C. P, S, Si, Ca. D. K, N, P, Si.
Câu 4. Khi nhiệt phân muối cacbonat, khí sinh ra là
A. SO3B. SO2C. CO2D. O2
Câu 5. Dãy chất nào sau đây đều là hiđrocacbon?
A. C2H4, C3H8, C2H4O2, CH3Cl. B. C3H8, C2H5O, CH3COOH, CaCO3.
C. C2H6, C4H10, CH3NO2, C2H5Cl. D. CH4, C4H10, C2H2, C2H6.
Câu 6. Hiđrocacbon nào sau đây chỉ có liên kết đơn?
A. CH4. B. C2H4. C. C2H2. D. C3H6.
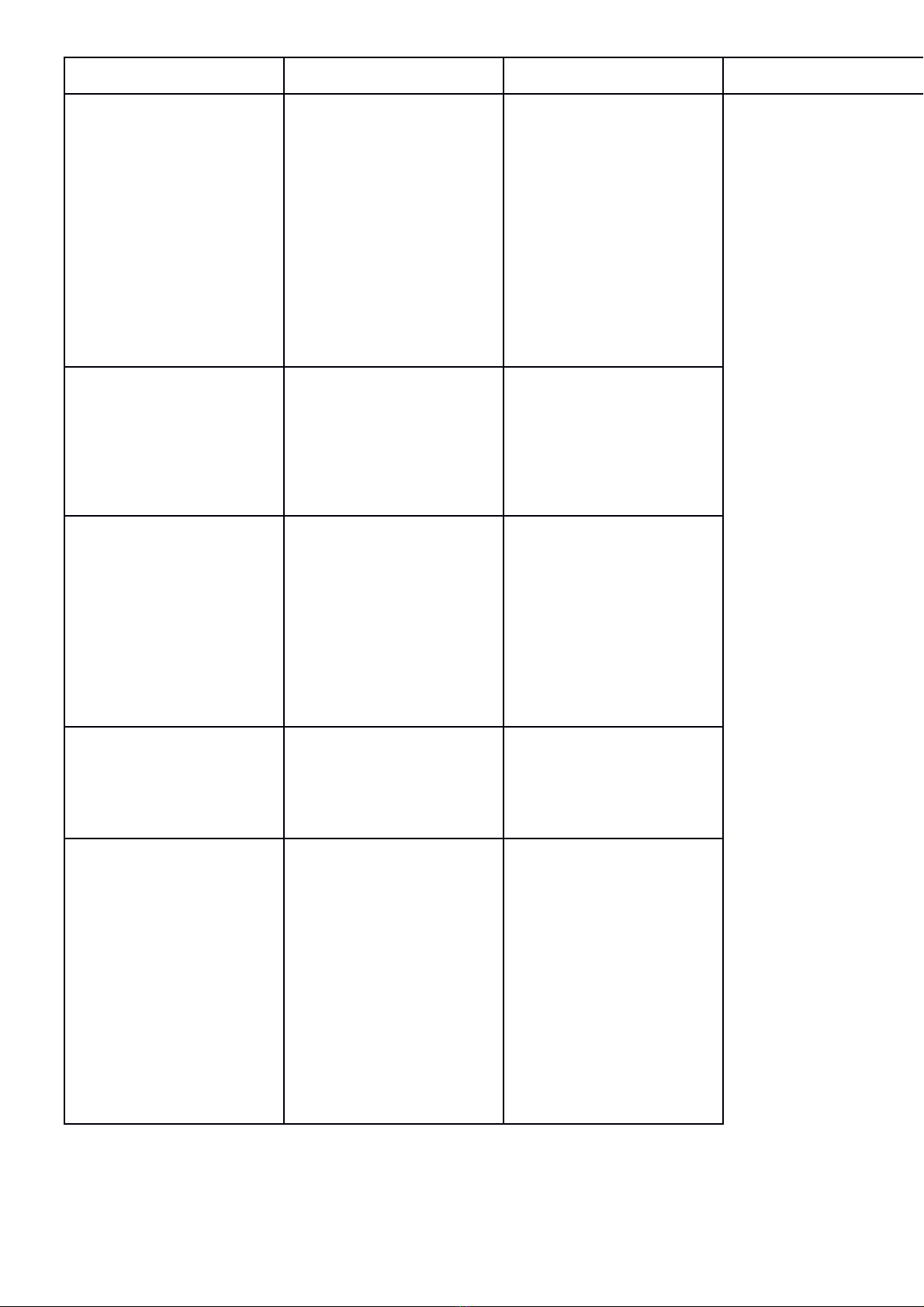
II. TỰ LUẬN (7,0 điểm)
Câu 1:(1đ) ViêIt các công thưIc câIu taKo có thể có cuMa: CH4; C2H6; C3H6 .
Câu 2:(2đ) Biết nguyên tử nguyên tố X có điện tích hạt nhân là 17+.
a. Xác định vị trí của X trong bảng hệ thống tuần hoàn.
b. Nêu các tính chất hóa học cơ bản của X.
Câu 3:(2đ)Thực hiện chuỗi phản ứng(ghi rõ điều kiện phản ứng nếu có)
C → CO2 → Ca(HCO3)2 → CaCO3 → CaO
Câu 4: a. (1đ) Đốt cháy hoàn toàn m gam Fe trong khí Cl2 dư, thu được 6,5 gam muối.
Tính m.
b. (1đ) Cho 1,06 gam muối cacbonat hóa trị I tác dụng hết với dung dịch HCl thấy thoát
ra 224 ml khí cacbonic (đktc). Xác định công thức phân tử của muối cacbonat.
Cho Mg = 24; Fe= 56; Na=23; C=12; O=16; Cl=35,5
BÀI LÀM
………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………