
Y Học TP. Hồ Chí Minh * Tập 24 * Số 2 * 2020 Nghiên cứu
B – Khoa học Dược 131
XÂY DỰNG QUY TRÌNH ĐỊNH LƯỢNG ĐỒNG THỜI IRBESARTAN VÀ
HYDROCLOROTHIAZID TRONG HUYẾT TƯƠNG NGƯỜI
BẰNG KỸ THUẬT LC-MS/MS
Chương Ngọc Nãi
*
, Lê Thị Đào
**
, Lê Nguyễn Trung Nguyên
*
, Nguyễn Văn Trung
*
,
Trần Việt Hùng
*
, Nguyễn Đức Tuấn
**
TÓM TẮT
Mở đầu: Phối hợp của irbesartan (IRB) và hydroclorothiazid (HCTZ) được chỉ định trong điều trị phù nề và
tăng huyết áp. Các nghiên cứu lâm sàng về IRB và HCTZ cho thấy sự kết hợp này có hiệu quả lâm sàng. Cho đến
nay, chỉ có một chế phẩm phối hợp IRB và HCTZ được sản xuất trong nước với giá thành rẻ hơn so với các sản
phẩm ngoại nhập. Để chứng minh hiệu quả điều trị tương đương giữa thuốc generic và thuốc phát minh, cần
phải đánh giá tương đương sinh học in vivo. Kỹ thuật LC-MS/MS có nhiều ưu điểm như độ nhạy và tính đặc
hiệu cao, thời gian phân tích ngắn và giới hạn định lượng các chất thấp trên các nền mẫu dịch sinh học. Vì vậy, kỹ
thuật này đang được áp dụng phổ biến để định lượng hoạt chất trong dịch sinh học. Hiện tại, chỉ có một vài công
trình định lượng đồng thời IRB và HCTZ trong huyết tương người bằng kỹ thuật LC-MS/MS được công bố
trên thế giới. Tuy nhiên, cho đến nay chưa có tác giả nào trong nước công bố quy trình định lượng đồng
thời IRB và HCTZ trong huyết tương người. Do đó, đề tài này được thực hiện với mục tiêu xây dựng và
thẩm định quy trình định lượng đồng thời irbesartan và hydroclorothiazid trong huyết tương người bằng
kỹ thuật LC-MS/MS theo hướng dẫn của US-FDA và EMA, là cơ sở để phục vụ cho việc đánh giá tương đương
sinh học của các chế phẩm chứa IRB và HCTZ.
Đối tượng nghiên cứu: IRB và HCTZ trong các mẫu huyết tương người giả lập.
Phương pháp nghiên cứu: Mẫu huyết tương giả lập chứa các chất phân tích và chuẩn nội telmisartan được
xử lý bằng các phương pháp như kết tủa protein với methanol, acetonitril; chiết lỏng-lỏng với tert-butyl methyl
ether, ethyl acetat và hỗn hợp tert-butyl methyl ether -ethyl acetat. Mẫu sau khi xử lý sẽ được định lượng bằng kỹ
thuật LC-MS/MS, sử dụng cột sắc ký pha đảo, pha động methanol và đệm amoni format 5 mM pH 5. Sau cùng,
quy trình định lượng được thẩm định theo hướng dẫn của US-FDA và EMA.
Kết quả: IRB, HCTZ và chuẩn nội đã được ion hóa bằng kỹ thuật ESI và được ghi phổ bằng kỹ thuật
MRM để thu được các ion phân tử và ion phân mảnh dùng cho định lượng. Quy trình định lượng đồng
thời IRB và HCTZ trong huyết tương người bằng kỹ thuật LC-MS/MS đã được xây dựng, sử dụng cột sắc
ký Gemini C18 (250 x 2 mm; 5 µm), pha động methanol và đệm amoni format 5 mM, pH 5 (80:20, tt/tt),
tốc độ dòng 0,4 ml/phút. Mẫu huyết tương giả lập được xử lý bằng phương pháp chiết lỏng-lỏng với hỗn
hợp tert-butyl methyl ether - ethyl acetat (50:50, tt/tt) cho hiệu suất chiết trên 95%. Quy trình định lượng đã
được thẩm định đạt yêu cầu của một quy trình phân tích thuốc trong dịch sinh học.
Kết luận: Quy trình định lượng đồng thời IRB và HCTZ trong huyết tương người bằng kỹ thuật LC-
MS/MS đã được xây dựng và thẩm định với độ nhạy, độ đặc hiệu và độ chính xác cao. Quy trình có thể được ứng
dụng để đánh giá sinh khả dụng và tương đương sinh học của các chế phẩm chứa IRB và HCTZ.
Từ khóa: LC-MS/MS, irbesartan, hydroclorothiazid, huyết tương người
*
Viện Kiểm nghiệm thuốc Thành phố Hồ Chí Minh
**
Khoa Dược, Đại học Y Dược Thành phố Hồ Chí Minh
Tác giả liên lạc: PGS.TS. Nguyễn Đức Tuấn ĐT: 0913799068 Email: ductuan@ump.edu.vn

Nghiên cứu Y Học TP. Hồ Chí Minh * Tập 24 * Số 2 * 2020
B – Khoa học Dược
132
ABSTRACT
DEVELOPMENT OF LC-MS/MS METHOD FOR SIMULTANEOUS DETERMINATION OF
IRBESARTAN AND HYDROCHLOROTHIAZIDE IN HUMAN PLASMA
Chuong Ngoc Nai, Le Thi Dao, Le Nguyen Trung Nguyen, Nguyen Van Trung,
Tran Viet Hung, Nguyen Duc Tuan
* Ho Chi Minh City Journal of Medicine * Vol. 24 - No. 2 - 2020: 131 - 141
Background - Objectives: Combination of irbesartan (IBR) and hydrochlorothiazide (HCTZ) is indicated
in the treatment of edema and hypertension. Clinical studies on IRB and HCTZ suggest that this combination is
effective. So far, there has been only one formulation of IRB and HCTZ combination produced locally with a
competitive price than one of imported products. In order to prove clinically equivalent efficacy between generic
and patent drugs, the in vivo bioequivalence study is mandatory. The LC-MS/MS technique has several
advantages such as high sensitivity and specificity, short analysis time and low limit of quantitation. This
technique is being applied commonly to quantify active ingredients in biological fluids. There have been several
simultaneous quantitative studies of IRB and HCTZ in human plasma by LC-MS/MS until now. However, no
local authors have published the simultaneous quantitative studies of IRB and HCTZ in human plasma, so far.
Therefore, this study has been performed with the aim of development and validation of the simultaneous
quantitative procedure of irbesartan and hydrochlorothiazide in human plasma by LC-MS/MS in accordance with
the guidelines of US-FDA and EMA, contributing to the in vivo bioequivalence study of pharmaceuticals
containing IRB and HCTZ.
Method: The object of this study is IRB and HCTZ spiked into blank human plasma samples. Method: Blank
human plasma samples containing the analytes and telmisartan as internal standard, were treated by protein
precipitation with methanol, acetonitrile; liquid-liquid extraction with tert-butyl methyl ether, ethyl acetate and
mixture of tert-butyl methyl ether and ethyl acetate. The treated samples were quantified by LC-MS/MS, using
reverse phase column, mobile phase containing methanol and ammonium formate buffer 5 mM with pH 5.
Finally, the quantitative procedure was validated on the basis of FDA and EMA guidelines on bioanalytical
method validation.
Results: IRB, HCTZ and internal standard were ionized using ESI source and detected by multiple reaction
monitoring (MRM) mode to obtain molecular ions and fragment ions for quantification. The procedure for
simultaneous assay of IRB and HCTZ in human plasma by LC-MS/MS was developed, using Gemini C18
column (250 x 2 mm; 5 µm), mobile phase containing methanol and ammonium formate buffer 5 mM with pH 5
(80:20, v/v), and flow rate of 0.4 ml/min. The human plasma samples were treated by liquid-liquid extraction with
a mixture of tert-butyl methyl ether and ethyl acetate (50:50, v/v), which gave the recovery above 95%. The
procedure was successfully validated with general requirements for a bioanalytical procedure.
Conclusion: The procedure for simultaneous assay of IRB and HCTZ in human plasma by LC-MS/MS was
succesfully developed and validated, that proves high sensitivity, specificity and accuracy. The procedure can be
applied for in vivo bioequivalence study of combination medical products containing IBR and HCTZ.
Keywords: LC-MS/MS, irbesartan, hydrochlorothiazide, human plasma
ĐẶT VẤN ĐỀ
Phối hợp của irbesartan (IRB) và
hydroclorothiazid (HCTZ) được chỉ định
trong điều trị phù nề và tăng huyết áp. Các
nghiên cứu lâm sàng về IRB và HCTZ cho
thấy sự kết hợp này có hiệu quả lâm sàng
(1)
.
Cho đến nay, chỉ có một chế phẩm phối hợp
IRB và HCTZ được sản xuất trong nước với
Y Học TP. Hồ Chí Minh * Tập 24 * Số 2 * 2020 Nghiên cứu
B – Khoa học Dược 133
giá thành rẻ hơn so với các sản phẩm ngoại
nhập. Để giảm chi phí điều trị cho người bệnh
thì cần phải đánh giá tương đương sinh học
giữa thuốc generic và thuốc phát minh. Kỹ
thuật LC-MS/MS có nhiều ưu điểm như độ
nhạy và tính đặc hiệu cao, thời gian phân tích
ngắn và giới hạn định lượng các chất thấp trên
các nền mẫu dịch sinh học. Vì vậy, kỹ thuật
này đang được áp dụng phổ biến để định
lượng hoạt chất trong dịch sinh học. Hiện tại,
chỉ có một vài công trình định lượng đồng thời
IRB và HCTZ trong huyết tương người bằng
kỹ thuật LC-MS/MS được công bố trên thế
giới
(2,3)
. Tuy nhiên, cho đến nay chưa có tác giả
nào trong nước công bố quy trình định lượng
đồng thời IRB và HCTZ trong huyết tương
người. Bài báo này công bố một quy trình định
lượng đồng thời irbesartan và
hydroclorothiazid trong huyết tương người
bằng kỹ thuật LC-MS/MS theo hướng dẫn của
US-FDA và EMA, là cơ sở để phục vụ cho việc
đánh giá tương đương sinh học của các chế
phẩm chứa IRB và HCTZ.
ĐỐI TƯỢNG - PHƯƠNG PHÁP NGHIÊN CỨU
Đối tượng nghiên cứu
IRB và HCTZ trong các mẫu huyết tương
người giả lập.
Nguyên vật liệu
Chất chuẩn
Irbesartan (IRB) có số lô QT201 040717, hàm
lượng 99,40% tính trên nguyên trạng;
Telmisartan (chuẩn nội, IS) có số lô QT217
030617, hàm lượng 99,70% tính trên nguyên
trạng. Tất cả do Viện Kiểm nghiệm thuốc TP. Hồ
Chí Minh cung cấp. Hydroclorothiazid (HCTZ)
có số lô 0114308.01, hàm lượng 99,55% tính trên
nguyên trạng do Viện Kiểm nghiệm thuốc Trung
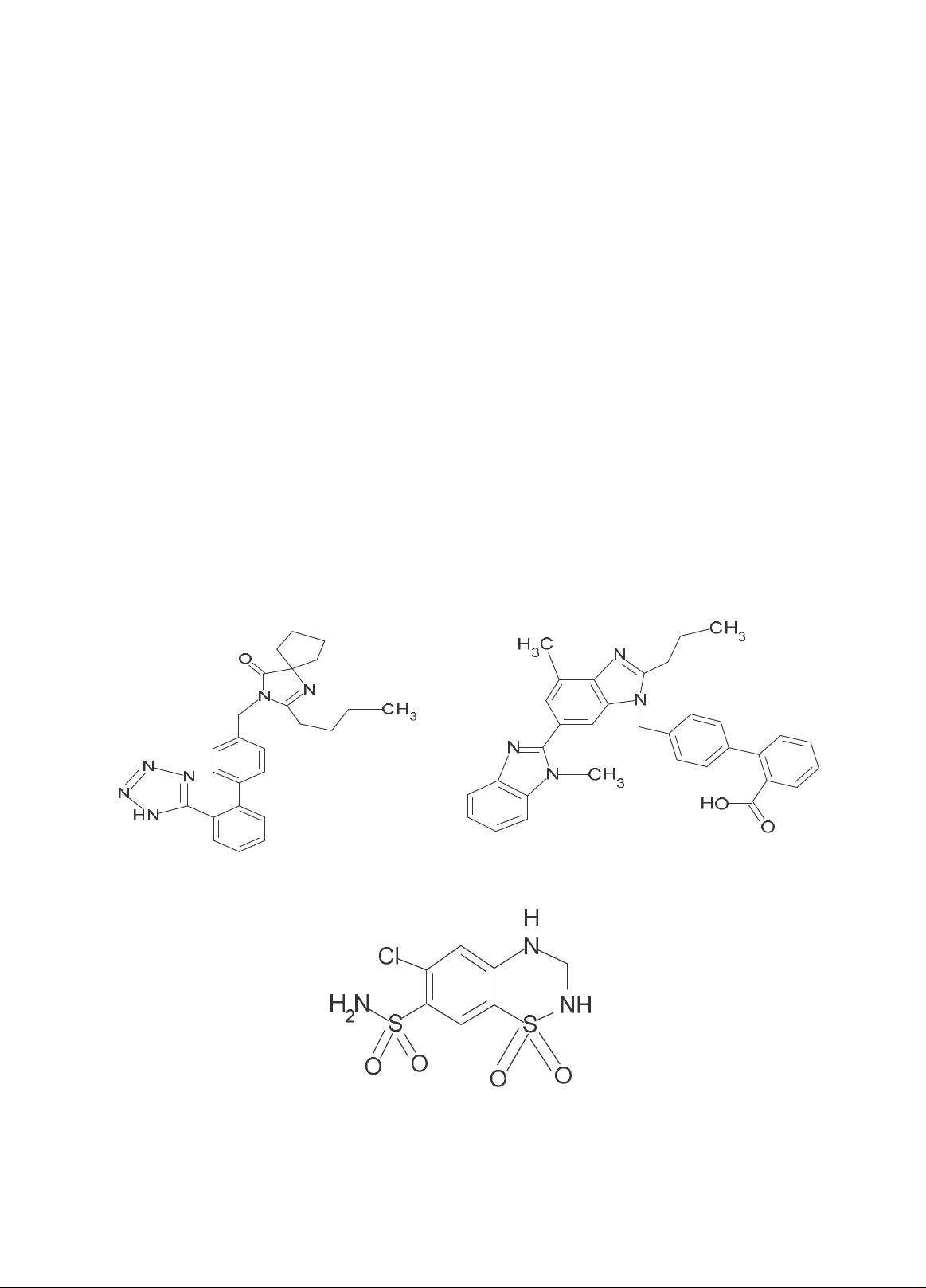
ương cung cấp. Hình 1 minh họa công thức cấu
tạo của IRB, HCTZ và IS.
1
2
3
4
5
6
1'
2'
3'
4'
5'
6'
1
2
34
5
2
3
45
1
6
7
8
9
1
2
3
4
5
6
1'
2'
3'
4'
5'
6'
1
2
34
5
2
3
45
1
6
7
8
9
Irbesartan (IRB)
2
1
3
4
5
6
1'
2'
3'
4'
5' 6'
1
2
3
4
5
67
1
2
3
4
5
6
7
2
1
3
4
5
6
1'
2'
3'
4'
5' 6'
1
2
3
4
5
67
1
2
3
4
5
6
7
Telmisartan (IS)
4
12
3
5
6
7
8
4
12
3
5
6
7
8
Hydroclorothiazid (HCTZ)
Hình 1. Công thức cấu tạo của irbesartan, hydroclorothiazid và chuẩn nội telmisartan

Nghiên cứu Y Học TP. Hồ Chí Minh * Tập 24 * Số 2 * 2020
B – Khoa học Dược
134
Dung môi, hoá chất
Acetonitril và methanol đạt tiêu chuẩn dùng
cho LC-MS. Ethyl acetat, tert-butyl methyl ether,
dicloromethan, acid phosphoric, amoni format,
acid formic đạt tiêu chuẩn phân tích.
Huyết tương trắng
Do bệnh viện Truyền máu và Huyết học TP.
Hồ Chí Minh cung cấp, được bảo quản ở -25
o
C.
Thiết bị và dụng cụ phân tích
Các thiết bị phân tích đều được hiệu chuẩn
theo yêu cầu của GLP và ISO/IEC 17025, bao
gồm: hệ thống LC-MS/MS 8040 (Shimadzu -
Nhật Bản), cân phân tích (Mettler Toledo - Thuỵ
Sĩ) và máy đo pH (Mettler Toledo - Thuỵ Sĩ). Các
dụng cụ thủy tinh đạt yêu cầu chính xác dùng
trong phân tích: bình định mức, micropipet.
Phương pháp nghiên cứu
Chuẩn bị mẫu
Dung dịch chuẩn
Gồm IRB, HCTZ, IS được pha trong
methanol với nồng độ mỗi chất là 1 µg/mL để
tiến hành khảo sát điều kiện khối phổ. Hỗn hợp
chuẩn gồm IRB, HCTZ, IS được pha trong
methanol với nồng độ mỗi chất là 100 ng/mL để
tiến hành khảo sát điều kiện sắc ký. Mẫu giả lập
được chuẩn bị bằng cách thêm hỗn hợp chuẩn
vào huyết tương trắng với tỷ lệ 5% thể tích.
Khảo sát điều kiện khối phổ
Quy trình phân tích được thực hiện trên hệ
thống LC-MS/MS với các điều kiện khối phổ ban
đầu như tốc độ dòng khí nitơ 15,0 lít/phút, tốc độ
dòng khí phun 3,0 lít/phút, nhiệt độ khí bay hơi
250
o
C, nhiệt độ buồng ion hóa 400
o
C, áp suất khí
phun 25 psi, điện thế mao quản 4000 V.
Các điều khảo sát bao gồm : chế độ ESI để
khảo sát mảnh ion phân tử của các chất, chế độ
MRM để khảo sát mảnh ion định lượng của
các chất, thế phân mảnh và năng lượng va
chạm được khảo sát và tối ưu hóa bằng công
cụ tối ưu hóa tự động Optimize Voltage của
phần mềm Lab Solutions 5.0 sao cho thu được
tín hiệu các mảnh ion có tỷ số khối lượng/điện
tích (m/z) cao nhất.
Khảo sát điều kiện sắc ký
Dựa vào đặc tính, cấu trúc hóa học của các
chất phân tích và tham khảo tài liệu được công
bố
(2)
, các điều kiện sắc ký sau đây được lựa chọn
để khảo sát: hệ pha động acetonitril/ methanol –
amoni format 5 mM (pH từ 3 – 6), thay đổi tỷ lệ
thích hợp và nồng độ amoni format; Tốc độ
dòng 0,35 – 0,45 mL/phút; Nhiệt độ cột sắc ký 30
- 45
o
C; Thể tích tiêm mẫu 2 – 10 µL. Chọn điều
kiện sắc ký thích hợp sao cho các pic hoạt chất và
pic chất chuẩn nội cân đối, thời gian phân tích
ngắn và tín hiệu cao.
Khảo sát phương pháp xử lý mẫu
Dựa theo các công trình đã công bố
(2,4)
và độ
phân cực của chất phân tích, phương pháp tủa
protein và chiết lỏng - lỏng đã được lựa chọn.
Chọn phương pháp xử lý mẫu sao cho hiệu suất
chiết cao, ổn định, sự ảnh hưởng của nền mẫu là
tối thiểu.
Xác định khoảng nồng độ định lượng
Sau khi đã thiết lập được điều kiện sắc ký,
điều kiện khối phổ và phương pháp xử lý mẫu,
cần phải tính toán xây dựng khoảng nồng độ
tuyến tính của từng hoạt chất trong quy trình và
các mức nồng độ của các mẫu kiểm chứng
(LLOQ, LQC, MQC, HQC) phù hợp với đường
chuẩn và theo những hướng dẫn của quy trình
định lượng thuốc trong dịch sinh học
(5,6)
. Dựa
vào nồng độ C
max
của IRB và HCTZ từ các tài liệu
tham khảo
(2,3)
xác định khoảng nồng độ định
lượng các hoạt chất.
Thẩm định quy trình phân tích:
Quy trình định lượng IRB và HCTZ trong
huyết tương người bằng kỹ thuật LC-MS/MS
được thẩm định dựa theo những quy định và
yêu cầu trong hướng dẫn của US-FDA và
EMA về các chỉ tiêu tính đặc hiệu; đường
chuẩn và khoảng tuyến tính; giới hạn định
lượng dưới; độ đúng và độ chính xác; hiệu
suất chiết; ảnh hưởng của nền mẫu, lượng
Y Học TP. Hồ Chí Minh * Tập 24 * Số 2 * 2020 Nghiên cứu
B – Khoa học Dược 135
mẫu tồn dư và độ pha loãng; độ ổn định của
hoạt chất
(5,6)
.
KẾT QUẢ
Khảo sát điều kiện khối phổ
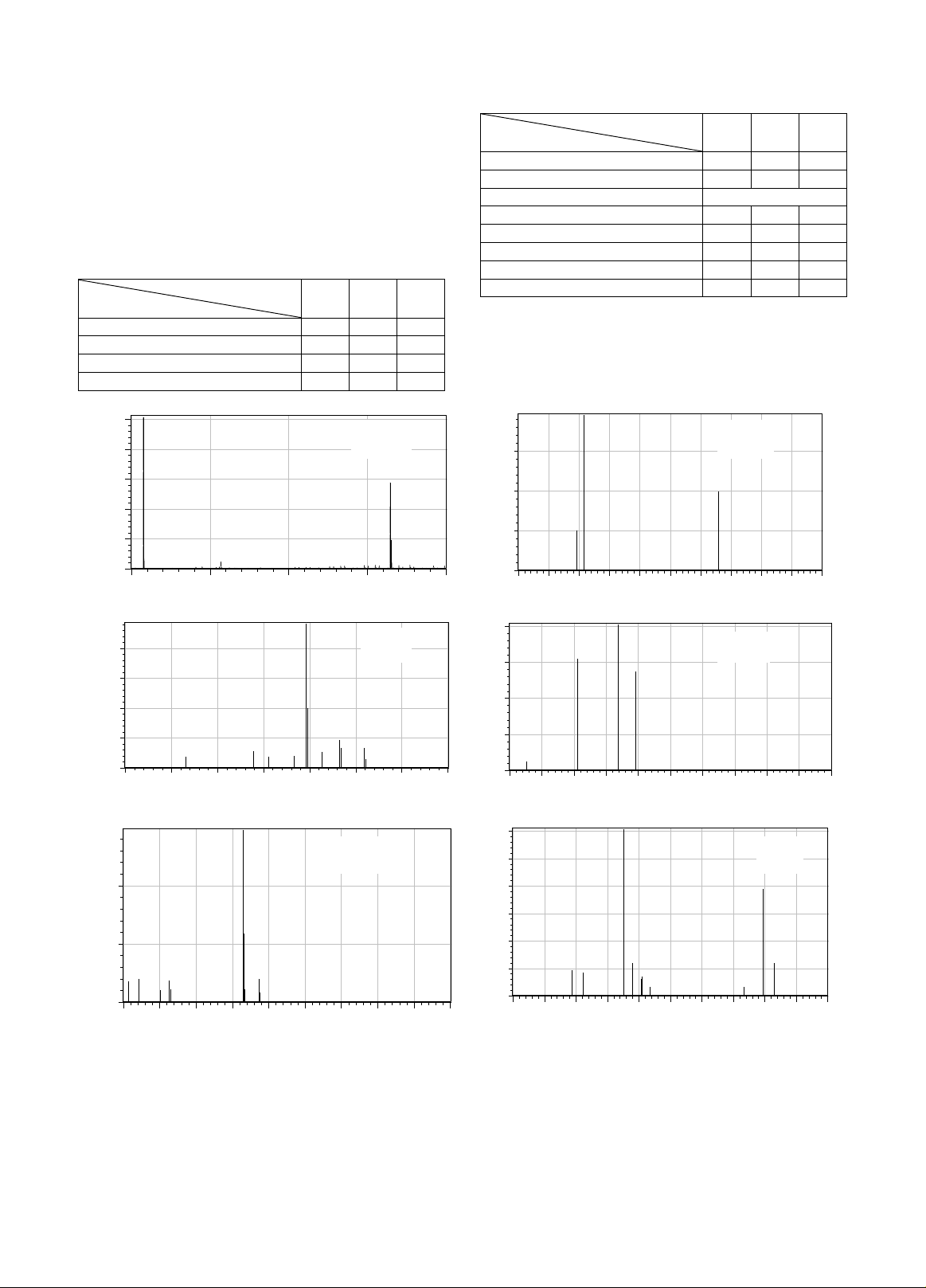
Bảng 1. Các thông số khối phổ tối ưu để phân tích
IRB, HCTZ và IS
Hoạt chấ
t
Thông số IRB HCTZ
IS
Kiểu ion hóa ESI + - +
Điện thế ion hóa (V) 4000 4000 4000
Nhiệt độ khí bay hơi (
o
C) 250 250 250
Tốc độ dòng khí phun (L/phút) 3 3 3
Hoạt chấ
t
Thông số IRB HCTZ
IS
Tốc độ dòng khí bay hơi (L/phút) 15 15 15
Nhiệt độ buồng ion hoá (
o
C) 400 400 400
Chế độ ghi phổ MRM
Thế Q1 (V) -24 14 -24
Năng lượng va chạm (V) -26 20 -50
Thế Q2 (V) -20 16 -26
Ion phân tử 429,15
295,90
515,00
Ion phân mảnh 207,00
268,95
276,10
Bảng 1 tóm tắt điều kiện khối phổ tối ưu để
phân tích IRB và HCTZ. Hình 2 minh họa phổ
khối của các chất phân tích.
100 200 300 400 m/z
0.0
1.0
2.0
3.0
4.0
5.0Inten. (x1,000,000)
115
429
100 150 200 250 300 350 400 450 500 550 m/z
0.0
0.5
1.0
1.5
Inten. (x1,000,000)
207
429
195
100 150 200 250 300 350 400 m/z
0.00
0.25
0.50
0.75
1.00
Inten. (x10,000,000)
296
298
332 359
239
165
100 150 200 250 300 350 400 450 500 550 m/z
0.0
1.0
2.0
3.0
4.0Inten. (x100,000)
269
205 296
126
350 400 450 500 550 600 650 700 750 m/z
0.0
2.5
5.0
Inten. (x1,000,000)
515
537
371 413
100 150 200 250 300 350 400 450 500 550 m/z
0.00
0.25
0.50
0.75
1.00
1.25
1.50 Inten. (x1,000,000)
276
497
515289
193 317 467
Hình 2. Phổ khối (ion phân tử và ion phân mảnh) của IRB (A và B), HCTZ (C và D), và IS (E và F) ở
cùng nồng độ 1 µg/mL
Khảo sát điều kiện sắc ký
Quy trình phân tích được thực hiện trên hệ
thống LC-MS/MS với các điều kiện sắc ký ban
đầu như sau: cột sắc ký Gemini C18 (250 x 2
mm; 5 µm), nhiệt độ cột 40
o
C, tốc độ dòng 0,4
mL/phút, thể tích tiêm 5 µL. Hỗn hợp chuẩn
(C)
(A) (B)
(D)
(E) (F)
)











![Tổng hợp câu hỏi trắc nghiệm Nhi khoa [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251016/phuongnguyen2005/135x160/41821768534165.jpg)














