
kiÓm nghiÖm thuèc b»ng c¸c ph−¬ng ph¸p hãa häc
Môc tiªu häc tËp
3. Tr×nh bµy ®−îc c¸ch ®Þnh tÝnh vµ x¸c ®Þnh giíi h¹n t¹p chÊt trong thuèc.
4. Gi¶i thÝch ®−îc kü thuËt ®Þnh l−îng c¸c acid, base vµ c¸c lo¹i muèi
trong m«i tr−êng khan.
5. Tr×nh bµy ®−îc c¸ch sö dông thuèc thö Karl Fischer ®Ó x¸c ®Þnh hµm
l−îng n−íc trong c¸c mÉu ph©n tÝch r¾n, trong dung m«i h÷u c¬.
6. ViÕt ®−îc ph−¬ng tr×nh ph¶n øng ®Þnh l−îng mét sè chÊt h÷u c¬
(polyol, vµ amino alcol) b»ng thuèc thö periodat.
7. Ph©n tÝch ®−îc øng dông cña cÆp ion trong kiÓm nghiÖm thuèc.
2.1. C¸c ph¶n øng ®Þnh tÝnh
2.1.1. Acetat
Ph¶n øng víi c¸c acid (m¹nh h¬n acid acetic) gi¶i phãng acid acetic cã
mïi chua:
•
•
•
•
CH3COO− + H+ = CH3COOH
Víi dung dÞch FeCl3 lo·ng cho phøc mµu ®á [Fe3(OH)2(CH3COO)6]+. Khi
pha lo·ng vµ ®un s«i sÏ cho kÕt tña mµu ®á:
[Fe3(OH)2(CH3COO)6]+ + 4H2O = 3Fe(OH)2CH3COO↓®á + 3CH3COOH + H+
Víi H2SO4 ®Æc vµ C2H5OH t¹o ra este etyl acetat cã mïi th¬m:
O
2
H
5
H
2
COOC
3
CH
dÆc SOH
5
H
2
OHCCOOH
3
CH 42 +⎯⎯⎯⎯⎯→⎯+
2.1.2. Amoni (muèi)
BÞ ph©n huû khi ®un nãng víi dung dÞch NaOH, gi¶i phãng khÝ NH3:
NH4
+ OH- = NH3 H2O
++
NhËn biÕt NH3 b»ng c¸c dÊu hiÖu: Mïi khai, lµm xanh giÊy qu× ®á tÈm
−ít, lµm hång giÊy tÈm phenolphtalein.
37

Thuèc thö Nessler (dung dÞch kiÒm cña muèi Kaliiodomercurat – K2[HgI4]
ph¶n øng víi NH3 cho tña mµu ®á (l−îng nhá cho dung dÞch mµu vµng):
•
NH4 OH- = NH3 H2O
+
++
[
]
=++ 3KOH
4
HgI
2
2K
3
NH I ®á + 7KI + 2H2O
NHO
2.1.3. Arseniat
•
•
•
•
•
•
Ph¶n øng víi acid hypophosphor¬ hoÆc dung dÞch hypophosphit (thuèc thö
Bugo hay Tile): t¹o ra kÕt tña As nguyªn tè cã mµu n©u:
+− ++ 6HPO5H4AsO 23
3
4 4As n©u + 5H3PO4 + 3H2O
Ph¶n øng víi AgNO3: t¹o kÕt tña n©u ®á Ag3AsO4, tña nµy kh«ng tan trong
CH3COOH, tan trong HNO3, dung dÞch amoniac.
Ph¶n øng víi hçn hîp magnesi (MgCl2 + NH4OH + NH4Cl ): Cho kÕt tña
tinh thÓ tr¾ng magnesi amonarseniat :
AsO43− + Mg2+ + NH4+ = MgNH4AsO4 ↓ tr¾ng
2.1.4. Arsenit
Ph¶n øng Tile:
4AsO33− + 3H3PO2 + 12H+ = 4As ↓n©u + 3H3PO4 + 6H2O
Ph¶n øng víi AgNO3: t¹o ra kÕt tña tr¾ng h¬i vµng Ag3AsO3, tña nµy tan
trong HNO3 , trong dung dÞch amoniac.
Ph¶n øng khö b»ng hydro míi sinh (do Zn trong m«i tr−êng acid t¹o ra) :
c¸c hîp chÊt cña Arsen (c¶ AsO33− vµ AsO43− …) ®Òu thµnh AsH3 d¹ng khÝ:
AsO33− + 3Zn + 9H+ = AsH3↑ + 3Zn2+ + 3H2O
Cã thÓ nhËn ra AsH3 b»ng:
− Cho t¸c dông víi AgNO3:
AsH3 + 6AgNO3 3HNO3 + AsAg3.3AgNO3 (mµu vµng)
Hg
2
Hg
38
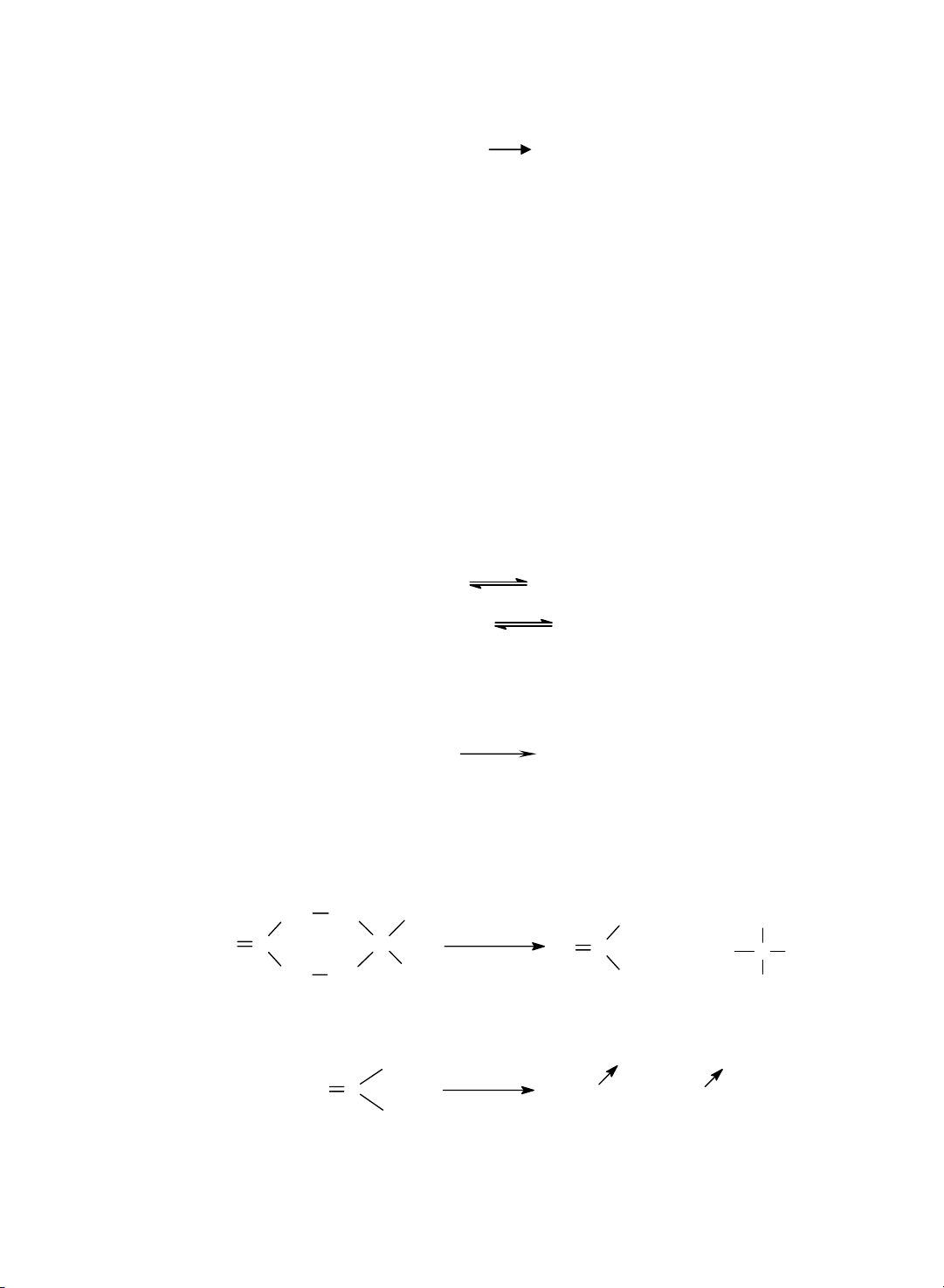
S¶n phÈm mµu vµng nµy dÔ bÞ thuû ph©n t¹o ra Ag ®en:
AsAg3.3AsNO3 + H2O H3AsO3 + 3HNO3 + 6Ag↓ ®en
− Cho t¸c dông víi HgCl2: t¹o thµnh hîp chÊt cã mµu tõ vµng sang ®á n©u:
AsH2(HgCl); AsH(HgCl)2; As(HgCl)3; As2Hg3
Ph¶n øng víi CuSO4: cho tña ®ång hydroarsenit mµu xanh lôc:
H3AsO3 + CuSO4 = CuHAsO3 ↓ xanh lôc + H2SO4
NÕu thªm NaOH vµ ®un nãng sÏ cã kÕt tña mµu ®á cña Cu2O:
2CuHAsO3 + 6NaOH = Na3AsO4 + Cu2O ↓ ®á + 4H2O + NaAsO3
(Ph¶n øng nµy dïng ®Ó ph©n biÖt gi÷a AsO43-vµ AsO33- ).
•
•
•
•
2.1.5. B¹c (muèi)
Ph¶n øng víi HCl cho tña tr¾ng AgCl, tña kh«ng tan trong HNO3 nh−ng
tan trong dung dÞch amoniac:
Ag+ + Cl− AgCl ↓ tr¾ng
AgCl ↓ + 2NH3 Ag(NH3)2+ + Cl−
Ph¶n øng víi formol trong m«i tr−êng kiÒm bÞ khö thµnh Ag cã mµu ®en
(ph¶n øng tr¸ng g−¬ng):
Ag+ + NH4OH → Ag2O Ag(NH3)2+ + Ag↓ + HCOOH
HCHO
2.1.6. Barbiturat
Khi ®un nãng víi kiÒm ®Æc, vßng ureid bÞ më gi¶i phãng ra c¸c s¶n phÈm
kh¸c nhau:
O C
NH
NH
CO
CO
C
R1
R2
NaOH
H2O
+O C
NH2
NH2
C
COONa
R2
COONa
R1
+
OC
NH2
NH2
to
+H2ONH3
2CO2
+
T¹o ph¶n øng phøc cã mµu víi c¸c ion kim lo¹i nh− Cu2+, Co2+ … •
39

2.1.7. Bari (muèi)
Ph¶n øng ®èt cho mµu ngän löa xanh lôc h¬i vµng.
•
•
•
Ph¶n øng víi H2SO4 cho kÕt tña BaSO4 mµu tr¾ng, kh«ng tan trong c¸c acid
v« c¬.
2.1.8. Bismuth (muèi)
Ph¶n øng thuû ph©n:
Bi3+ Cl-H2O BiOCl tr¾ng H+
2
++ +
T¸c dông víi dung dÞch kiÒm: cho tña Bi(OH)3 mµu tr¾ng, khi ®un nãng
víi n−íc ng¶ mµu vµng:
•
OH-
Bi3+ H2O
++
=Bi(OH)3 tr¾ng (BiO)OH vµng
Ph¶n øng víi S2-: cho tña n©u ®en Bi2S3 •
•
•
Ph¶n øng víi thioure: trong m«i tr−êng acid cho mµu vµng da cam hay
vµng xanh l¸ c©y (nhiÒu cho kÕt tña):
[Bi (H2N − CS − NH2)3 ](NO3)2: vµng da cam
[Bi (H2N − CS − NH2)3 ]Cl3: vµng xanh l¸ c©y
2.1.9. Borat
Hçn hîp muèi borat víi ethanol (hoÆc methanol) vµ H2SO4 ®Æc sÏ t¹o ra
ester trietyl borat, ®em ®èt ch¸y cho ngän löa mµu lôc:
Na2B4O7. H2O H+ Na+ H3BO3 H2O
6+
22+4 +
5
H3BO3 C2H5OH B
OC2H5
OC2H5
OC2H5
H2O
+
+2 H+3
Trong m«i tr−¬ng acid, borat chuyÓn thµnh acid boric, acid boric ph¶n øng
víi giÊy nghÖ (hoÆc cån nghÖ) cho mµu n©u ®á, sau ®ã tÈm −ít b»ng dung
dÞch kiÒm lo·ng (amoniac hoÆc natrihydroxyd) mµu n©u chuyÓn thµnh
mµu lam hay lôc (do sù t¹o phøc cña cucumin trong nghÖ víi acid boric).
•
40

2.1.10. Bromid
Ph¶n øng víi AgNO3: cho tña vµng nh¹t AgBr, tña nµy khã tan trong dung
dÞch amoniac 10M.
•
•
•
Ph¶n øng oxy ho¸ Br- thµnh Br2 b»ng: PbO2 + CH3COOH hoÆc KMnO4 +
H2SO4. NhËn biÕt Br2 b»ng c¸ch chiÕt vµo cloroform cã mµu vµng hoÆc
®á n©u:
2Br− + PbO2 + 4H+ = Br2 + Pb2+ + 2H2O
10Br− + 2MnO4− + 16H+ = 5Br2 + 2Mn2+ + 8H2O
2.1.11. Calci (muèi)
Ph¶n øng víi amoni oxalat: trong m«i tr−êng trung tÝnh hoÆc CH3COOH
lo·ng cho kÕt tña mµu tr¾ng, kÕt tña nµy dÔ tan trong c¸c acid v« c¬ :
Ca (NH4)2C2O4 = CaC2O4 tr¾ng NH4
+
2+ +2+
Ph¶n øng víi Kali ferocyanid: trong m«i tr−êng NH4Cl cho tña mµu tr¾ng:
Ca K4 [(Fe(CN))6] NH4
2+ 2+
++= Ca(NH4)2[Fe(CN)6] tr¾ng 4K
++
•
2.1.12. Ch× (muèi)
Ph¶n øng víi dung dÞch KI: cho kÕt tña mµu vµng, tan trong KI thõa:
•
Pb
2+ +2I -=PbI vµng
2
+2I -=
PbI
2PbI4
2-
Tña PbI2 tan trong n−íc nãng, khi ®Ó nguéi kÕt tña trë l¹i.
Ph¶n øng víi dung dÞch K2CrO4 cho tña mµu vµng, tña dÔ tan trong HCl
vµ NaOH:
•
•
Pb2+ + K2CrO4 = PbCrO4↓ vµng + 2K+
2.1.13 Citrat (C6H5O73−)
Cho tña víi Ca++ khi ®un nãng. Tña nµy dÔ tan trong dung dÞch CH3COOH6M.
41




















![Bài giảng Sử dụng thuốc vận mạch trong cấp cứu tim mạch [Chuẩn Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260123/lionelmessi01/135x160/73691769159064.jpg)

![Bài giảng Kiểm nghiệm thuốc Trường CĐ Phương Đông Quảng Nam [Chuẩn Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260123/lionelmessi01/135x160/13921769180751.jpg)



