Copyright 2017 ® by Nguyễn Công Kiệt (FB: https://nguyencongkietbk)
NGUYỄN CÔNG KIỆT
( BeeClass.vn )
LÝ THUYẾT VÀ BÀI TẬP CHỌN LỌC
CHUYÊN ĐỀ ĐIỆN LI
Hệ thống lý thuyết bao quát toàn bộ chương trình
Bài tập vận dụng trích từ các đề thi chính thức của Bộ
Giúp xâu chuỗi và hệ thống kiến thức trong thời gian nhanh nhất

Copyright 2017 ® by Nguyễn Công Kiệt (FB: https://nguyencongkietbk)
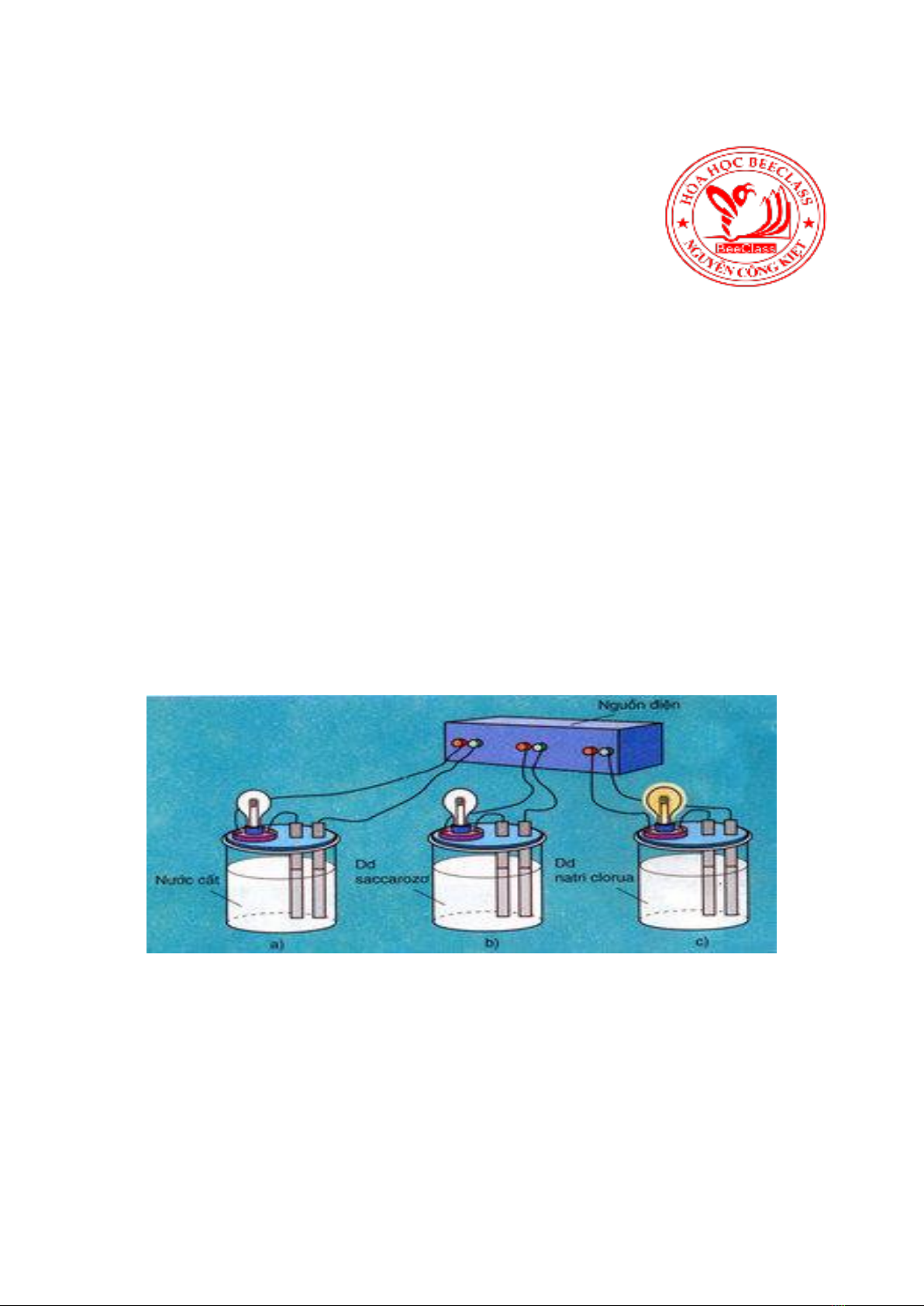
SỰ ĐIỆN LI VÀ H C DUNG D CH
(B -2015 )
HỆ THỐNG LÝ THUYẾT
+ Độ ện ly
+ Phân loại chấ ện ly
1.Chấ iện li mạnh: là những chất trong dung dịch nước điện li hoàn toàn thành các ion, quá trình điện li
là 1 chiều ( → )
Những chất điện li mạnh bao gồm:
Hầu hết các muối.
Các axit mạnh: HClO4, H2SO4, HNO3, HCl, HBr, HI, HMnO4…
Các ba zơ mạnh: Baz ơ kiềm, bari, canxi..
2.Chất điện li yếu: là những chất trong dung dịch nước chỉ điện li 1 phần thành ion còn phần lớn tồn tại
dưới dạng phân tử. Quá trình điện li là thuận nghịch (⇆ ).
Vd: NH4OH ⇆ NH4+ + OH-
Những chất điện li yếu bao gồm:
Các axit yếu: RCOOH, H2CO3, H2SO3, HNO2, H3PO4, H2S…
Các bazơ yếu: NH4OH, H2O, và các hi đrôxit không tan
3. Chất không điện li: là những chất tan vào nước hoàn toàn không điện li thành các ion. Chúng có thể là
chất rắn như Glucoz ơ C6H12O6, chất lỏng như CH3CHO, C2H5OH…
XIT B ZƠ MUỐI
AXIT:
I Đ ạ
1 Đ :
a rê ni út: Là chất phân li ra ion H+
Bronstet: là chất cho proton
2. Phân loại:
Axit mạnh: HCl, HBr, HI, H2SO4, HNO3, HClO4
Axit trung bình: H3PO4
Axit yếu: HF, H2S, HClO, HNO2, H3PO3 ( 2 nấc ), RCOOH, H2SiO3 ↓, H2CO3
II. Tính chất hóa học:
1. Tính axit

Copyright 2017 ® by Nguyễn Công Kiệt (FB: https://nguyencongkietbk)
a) Quỳ tím hóa đỏ
b) Tác dụng với bazơ tạo muối và nước
2HCl + CaO ⟶ CaCl2 + H2O
Fe2O3 + HNO3 ⟶Fe(NO3)2 + H2O
FeO + 2HCl ⟶FeCl2 + H2O
Fe3O4 + 8HCl ⟶ FeCl2 + 2FeCl3 + H2O
Chú ý: FeO, Fe3O4 + HNO3, H2SO4 đặc ⟶ Fe3+ + sản phẩm khử + H2O.
c) Tác dụng với bazơ tạo muối và nước
HCl + NaOH ⟶ NaCl + H2O
H2SO4 + Al(OH)3 ⟶ Al2(SO4)3 + H2O
Chú ý: Fe(OH)2 + HNO3, H2SO4 đặc ⟶ Fe3+ + sản phẩm khử + H2O.
d) Tác dụng với muối:
Điều kiện:
+ Tạo ra axit yếu hơn
+ Kết tủa không tan trong axit.
Vd: CaCO3 + 2HCl ⟶ CaCl2 + CO2 + H2O
Na2SO3 + H2SO4 ⟶ Na2SO4 + SO2 + H2O
AgNO3 + HCl ⟶ AgCl↓ + HNO3
BaCl2 + H2SO4 ⟶ BaSO4↓ + 2HCl.
e) Tác dụng với kim loại:
1. HX, H2SO4 + KL( trừ Cu, Ag, Hg, Pt, Au) ⟶ muối ( Fe2+, Cr2+ ) + H2.
2.. HNO3, H2SO4 đặc + KL( trừ Pt, Au) ⟶ muối ( Fe3+, Cr3+ ) + sản phẩm khử + H2O
HNO3 đặc nguội, H2SO4 đặc nguội bị thụ động với Fe, Al, Cr.
Kết lu n: axit thể hiện tính oxi hóa.
II, Một số axit thể hiện tính khử mạnh:
Bao gồm: H2S, HBr, HI, HCl.
H2S + Br2 + H2O → HBr + H2SO4
HCl + MnO2 ⟶ MnCl2 + Cl2 + H2O.
HI + FeCl3 ⟶ FeCl2 + I2 + HCl
III, Một số axit thể hiện tính oxi hóa mạnh:
Bao gồm: HNO3, H2SO4, HClO4.

Copyright 2017 ® by Nguyễn Công Kiệt (FB: https://nguyencongkietbk)
Tác dụng với phi kim: C, S, P ⟶ C+4, S+6, S+4, P+5
HNO3 + C ⟶ CO2 + NO2 + H2O
HNO3 + S ⟶ H2SO4 + NO + H2O
IV, riêng HF tác d ng với thủy tinh.
HF + SiO2 ⟶ SiF4 + H2O.
B ZƠ
I. Phân loại:
1. Baz ơ kiềm: MOH (M là kim loại kiềm), Ca(OH)2, Ba(OH)2, Sr(OH)2
2. Bazơ không tan: từ Mg(OH)2 ⟶Cu(OH)2
3. Hiđroxit lưỡng tính:
Zn(OH)2, Al(OH)3, Cr(OH)3, Pb(OH)2, Sr(OH)2, Sn(OH)2 riêng Cu(OH)2 và Be(OH)2 tan trong kiềm đặc.
4.Một số bazơ yếu: dd NH3, R(NH2)x
II, Tính chất hóa học:
1, Baz ơ kiềm:
a) làm đổi màu chất chỉ thị: - Quỳ tím ⟶ xanh
phenolphtalein không màu chuyển thành màu hồng
b) tác dụng với axit tạo thành muối và nước;
tạo thành muối gì phụ thuộc và tỉ lệ mol của OH- và axit ( H2S, H3PO3, H3PO4 )
c) tác dụng với oxit axit: CO2, SO2, P2O5, NO2
nOH-/nCO2, SO2
Chú ý: 2NO2 + 2OH- → NO3- + NO2- + H2O (Phản ứng oxi hóa khử)
d) Tác dụng với dung dịch muối tạo thành:
+ NH3 (NH4+): NH4Cl + NaOH → NH3↑ + H2O + NaCl
+ Bazơ kết tủa ( Mg(OH)2 → Cu(OH)2 ): 2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓.
+ Muối kết tủa: BaCO3, CaCO3, BaSO4, CaSO3, BaSO3: Ba(OH)2 + Na2SO4 → BaSO4↓ + 2NaOH.
Chú ý: muối axit
2NaOH + 2KHCO3 → Na2CO3 + K2CO3 + 2H2O
2NaOH dư + Ca(HCO3)2 → CaCO3↓ + Na2CO3 + H2O
Ba(HCO3)2 dư + NaOH → BaCO3↓ + NaHCO3 + H2O
(OH- + HCO3- → CO32- + H2O)
e) Tác dụng với Cl2:

Copyright 2017 ® by Nguyễn Công Kiệt (FB: https://nguyencongkietbk)
Cl2 + NaOH → NaCl + NaClO + H2O ( nước gia ven)
KOH + Cl2
→
KCl + KClO3 + H2O.
f) Tác dụng với oxit và hiđrô xit lưỡng tính:
ZnO, Al2O3, Cr2O3
Zn(OH)2, Al(OH)3, Cr(OH)3
Vd: ZnO + 2NaOH → Na2ZnO2 + H2O
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O.
2.Bazơ không tan:
a) tác dụng với axit tạo muối và nước.
b) bị nhiệt phân tạo oxit baz zơ và nước:
Mg(OH)2
→ MgO + H2O
Fe(OH)2 + O2
→ Fe2O3 + H2O
3.Hidroxit lưỡng tính:
Tác dụng với axit mạnh
Tác dụng với bazơ kiềm
4.dung dịch NH3 là 1 baz ơ yếu:
a) làm quỳ tím chuyển thành màu xanh.
b)tác dụng với axit tạo muối. tùy thuộc và tỉ lệ:
nNH3/nH3PO4
c) tác dụng với các muối (Mg2+ đến …) tạo bazơ kết tủa:
Mn+ + nNH3 + nH2O → M(OH)n + nNH4+
Các ba zơ : Zn(OH)2, Cu(OH)2, AgOH, Ni(OH)2 tan trong NH3 dư do tạo phức
MUỐI
I, Phân loại muối:
1, Muối axit (Đa axit tạo muối axit)
HS-, HSO3-, HSO4-, HCO3-, H2PO42-, H2PO3-
2, Muối trung hòa: gốc axit không còn H có khả năng phân li ra H+
Vd: S2-, SO32-, SO42-, PO43-, HPO3-
II, Môi rường của dung d ch muối:
Muối tạo bởi
Môi trường
pH
Chất chỉ thị
Axit mạnh, baz ơ mạnh
Trung tính
7
Quỷ tím không đổi màu


























