
M ĐUỞ Ầ
1. Tính c p thi t c a lu n ánấ ế ủ ậ
V t li u nanomet, m t trong s v t li u tiên ti n hi n nay, có ti m năng ngậ ệ ộ ố ậ ệ ế ệ ề ứ
d ng trong nhi u ngành công nghi p nh đi n t , quang h c, hóa ch t, g m s ,ụ ề ệ ư ệ ử ọ ấ ố ứ
luy n kim, gi y, môi tr ng, d c ph m, ch t d o,…v.v. Hi n nay, v t li u kíchệ ấ ườ ượ ẩ ấ ẻ ệ ậ ệ
th c nanomet vô c nh canxi cacbonat, silic đioxit, titan đioxit, clay, cacbon,…ướ ơ ư
vv và m t s lo i v t li u kích th c nanomet khác có nhu c u r t l n đn hàngộ ố ạ ậ ệ ướ ầ ấ ớ ế
tri u t n/năm.ệ ấ
Trong m i đn m i lăm năm v tr c, các nhà nghiên c u th gi i t pườ ế ườ ề ướ ứ ế ớ ậ
trung vào vi c t ng h p, xác đnh c u trúc và tính ch t c a v t li u nano. G n đây,ệ ổ ợ ị ấ ấ ủ ậ ệ ầ
yêu c u c a công nghi p đòi h i ph i s n xu t v t li u nano v i s l ng l n đãầ ủ ệ ỏ ả ả ấ ậ ệ ớ ố ượ ớ
b t bu c các nhà nghiên c u tìm ki m và phát tri n các ph ng pháp t ng h p v tắ ộ ứ ế ể ươ ổ ợ ậ
li u nano v i giá th p và công su t cao. ệ ớ ấ ấ
Trên th gi i hi n nay có nhi u ph ng pháp t ng h p v t li u kích th cế ớ ệ ề ươ ổ ợ ậ ệ ướ
nanomet đã đc thông báo và đc phát tri n. Các k thu t đi u ch khá phongượ ượ ể ỹ ậ ề ế
phú cho t ng lo i v t li u nano, ph thu c vào kích th c, hình thái c u trúc vàừ ạ ậ ệ ụ ộ ướ ấ
các tính ch t khác nhau mong mu n có đc v t li u đi u ch .ấ ố ượ ở ậ ệ ề ế
Canxi cacbonat là lo i v t li u có nhi u ng d ng trong th c ti n nh : làmạ ậ ệ ề ứ ụ ự ễ ư
ch t đn trong công nghi p s n xu t gi y, ch t đn cho cao su, kem đánh răng,ấ ộ ệ ả ấ ấ ấ ộ
ch t d o, s n, d c ph m, m ph m, keo dán…vv, ch t l ng s n ph m canxiấ ẻ ơ ượ ẩ ỹ ẩ ấ ượ ả ẩ
cacbonat đc đánh giá ch y u qua thành ph n hóa h c và các đc tr ng v t lý.ượ ủ ế ầ ọ ặ ư ậ
Đ tăng c ng kh năng phân tán và k t dính c a canxi cacbonatể ườ ả ế ủ trong ch tấ
n n, m t trong nh ng h ng nghiên c u hi n nay là bi n tính b m t c a canxiề ộ ữ ướ ứ ệ ế ề ặ ủ
cacbonat b ng nh ng nhóm ch c thích h p và gi m kích th c h t đn c nanoằ ữ ứ ợ ả ướ ạ ế ỡ
mét. Khi bi n tính phù h p, kh năng liên k t gi a ch t đn và v t li u tăng lên.ế ợ ả ế ữ ấ ộ ậ ệ
Còn khi gi m kích th c h t đn kích th c nano mét thì s phân tán s t t h n,ả ướ ạ ế ướ ự ẽ ố ơ
qua đó s c i thi n các tính ch t c a s n ph m.ẽ ả ệ ấ ủ ả ẩ
H n n a, Vi t Nam có ngu n nguyên li u đá vôi d i dào, ch t l ng kháơ ữ ệ ồ ệ ồ ấ ượ
cao nên c n đc ch bi n và ng d ng, góp ph n thúc đy phát tri n các ngànhầ ượ ế ế ứ ụ ầ ẩ ể
công nghi p khác.ệ
Hi n nay, có nhi u ph ng pháp đ đi u ch và bi n tính canxi cacbonatệ ề ươ ể ề ế ế
nh : ph ng pháp x lý natri cacbonat và amoni cacbonat có trong n c th i c aư ươ ử ướ ả ủ
công ngh s n xu t soda, ph ng pháp s n xu t b t nh d a trên quy trình x lýệ ả ấ ươ ả ấ ộ ẹ ự ử
n c c ng, ph ng pháp cacbonat hóa s a vôi b ng khí COướ ứ ươ ữ ằ 2 s d ng thi t b ph nử ụ ế ị ả
ng thông th ng, ph ng pháp cacbonat hóa dung d ch s a vôi trong h micellứ ườ ươ ị ữ ệ
đo, ph ng pháp m i: ph ng pháp k t t a tr ng tr ng cao…vv, s d ng cácả ươ ớ ươ ế ủ ọ ườ ử ụ
tác nhân bi n tính vô c , h u c . M i ph ng pháp có u đi m và nh c đi mế ơ ữ ơ ỗ ươ ư ể ượ ể
khác nhau v tri n khai l ng l n, v kích th c và hình thái c a h t thu đc [1,ề ể ượ ớ ề ướ ủ ạ ượ
2, 5, 44].
1

Trên c s phân tích các tài li u đã công b , phân tích nhu c u c a s n ph mơ ở ệ ố ầ ủ ả ẩ
và tính khoa h c c n gi i quy t, lu n án ọ ầ ả ế ậ “nghiên c u đi u ch nano CaCOứ ề ế 3 b ngằ
ph ng pháp k t t a tr ng tr ng caoươ ế ủ ọ ườ ” nh m m c đích nghiên c u kh năngằ ụ ứ ả
t ng h p canxi cacbonatổ ợ kích th c nano mét và kh năng tri n khai l ng l n. ướ ả ể ượ ớ
2. N i dung c a lu n ánộ ủ ậ
Nghiên c u thi t k , ch t o h thi t b k t t a tr ng tr ng cao;ứ ế ế ế ạ ệ ế ị ế ủ ọ ườ
Nghiên c u ch đ công ngh đi u ch nano-CaCOứ ế ộ ệ ề ế 3 hình thái l p ph ngậ ươ
b ng ph ng pháp k t t a tr ng tr ng cao;ằ ươ ế ủ ọ ườ
Nghiên c u các ch đ công ngh đi u ch CaCOứ ế ộ ệ ề ế 3 hình thái hình kim b ngằ
h ng pháp k t t a tr ng tr ng cao;ươ ế ủ ọ ườ
Nghiên c u đi u ch s n ph m nano-CaCOứ ề ế ả ẩ 3 bi n tính b m t b ng tácế ề ặ ằ
nhân bi n tính h u c ;ế ữ ơ
Th nghi m s d ng s n ph m nano-CaCOử ệ ử ụ ả ẩ 3 trong lĩnh v c s n, ch t d oự ơ ấ ẻ
và ngành công nghi p gi y.ệ ấ
3. Đóng góp m i c a lu n ánớ ủ ậ
Lu n án là công trình khoa h c đu tiên Vi t Nam nghiên c u và phát tri nậ ọ ầ ở ệ ứ ể
ph ng pháp k t t a tr ng tr ng cao có tính h th ng đ đi u ch v t li u nano-ươ ế ủ ọ ườ ệ ố ể ề ế ậ ệ
CaCO3 hình thái l p ph ng, CaCOậ ươ 3 hình kim và nano-CaCO3/St bi n tính b m tế ề ặ
s d ng h thi t b k t t a tr ng tr ng cao do lu n án t ch t o.ử ụ ệ ế ị ế ủ ọ ườ ậ ự ế ạ
4. Ý nghĩa khoa h c và th c ti n c a lu n ánọ ự ễ ủ ậ
Lu n án đóng góp vào vi c phát tri n và ng d ng ph ng pháp k t t a tr ngậ ệ ể ứ ụ ươ ế ủ ọ
tr ng cao đ t ng h p v t li u canxi cacbonat kích th c nanomet v i các hìnhườ ể ổ ợ ậ ệ ướ ớ
thái khác nhau và kh năng tri n khai l ng l n.ả ể ượ ớ
Vi t Nam, các nghiên c u c a lu n án này l n đu tiên đ c p đn vi cỞ ệ ứ ủ ậ ầ ầ ề ậ ế ệ
nghiên c u lý thuy t, thi t k , ch t o h thi t b k t t a tr ng tr ng cao gópứ ế ế ế ế ạ ệ ế ị ế ủ ọ ườ
ph n làm rõ c s khoa h c c a ph ng pháp k t t a tr ng tr ng cao trong quáầ ơ ở ọ ủ ươ ế ủ ọ ườ
trình t ng h p v t li u nano vô c nói chung và nano-CaCOổ ợ ậ ệ ơ 3 nói riêng.
Khác v i các ph ng pháp k t t a truy n th ng, ph ng pháp tr ng tr ngớ ươ ế ủ ề ố ươ ọ ườ
cao, đc bi t vi c rút ng n, đn gi n hóa quy trình s n xu t, h n ch s d ng cácặ ệ ệ ắ ơ ả ả ấ ạ ế ử ụ
nguyên li u đt ti n, ...vv là y u t thu n l i đ g n k t và thúc đy nhanh k tệ ắ ề ế ố ậ ợ ể ắ ế ẩ ế
qu nghiên c u sang tri n khai quy mô l n.ả ứ ể ở ớ
5. B c c c a lu n ánố ụ ủ ậ
Lu n án bao g m 123 trang (không k trang ph l c) v i 50 b ng s li u, 89ậ ồ ể ụ ụ ớ ả ố ệ
hình v và 66 tài li u tham kh o. Lu n án đc b c c g m ph n m đu, ph nẽ ệ ả ậ ượ ố ụ ồ ầ ở ầ ầ
n i dung, k t lu n, tài li u tham kh o và ph l c. Ph n n i dung chia làm 3ộ ế ậ ệ ả ụ ụ ầ ộ
ch ng: Ch ng 1. T ng quan; Ch ng 2. K thu t th c nghi m và ph ng phápươ ươ ổ ươ ỹ ậ ự ệ ươ
nghiên c u; Ch ng 3. K t qu và th o lu n.ứ ươ ế ả ả ậ
Ch ng 1: T NG QUANươ Ổ
1.1. CANXI CACBONAT
2
Canxi cacbonat là m t trong nh ng hóa ch t ph bi n trên trái đt v i côngộ ữ ấ ổ ế ấ ớ
th c hóa h c là CaCOứ ọ 3. Kh i l ng riêng c a CaCOố ượ ủ 3 kho ng 2,6 - 2,83 g/cmả3, tích
s tan c a nó trong n c là Tố ủ ướ n = 0,87.10-8 25ở0 C. Canxi cacbonat t n t i trong tồ ạ ự
nhiên các d ng khác nhau nh : aragonit, canxit, đá ph n, đá vôi, c m th ch hayở ạ ư ấ ẩ ạ
đá hoa và travertin. Aragonit và canxit là 2 d ng ph bi n c a canxi cacbonat. ạ ổ ế ủ
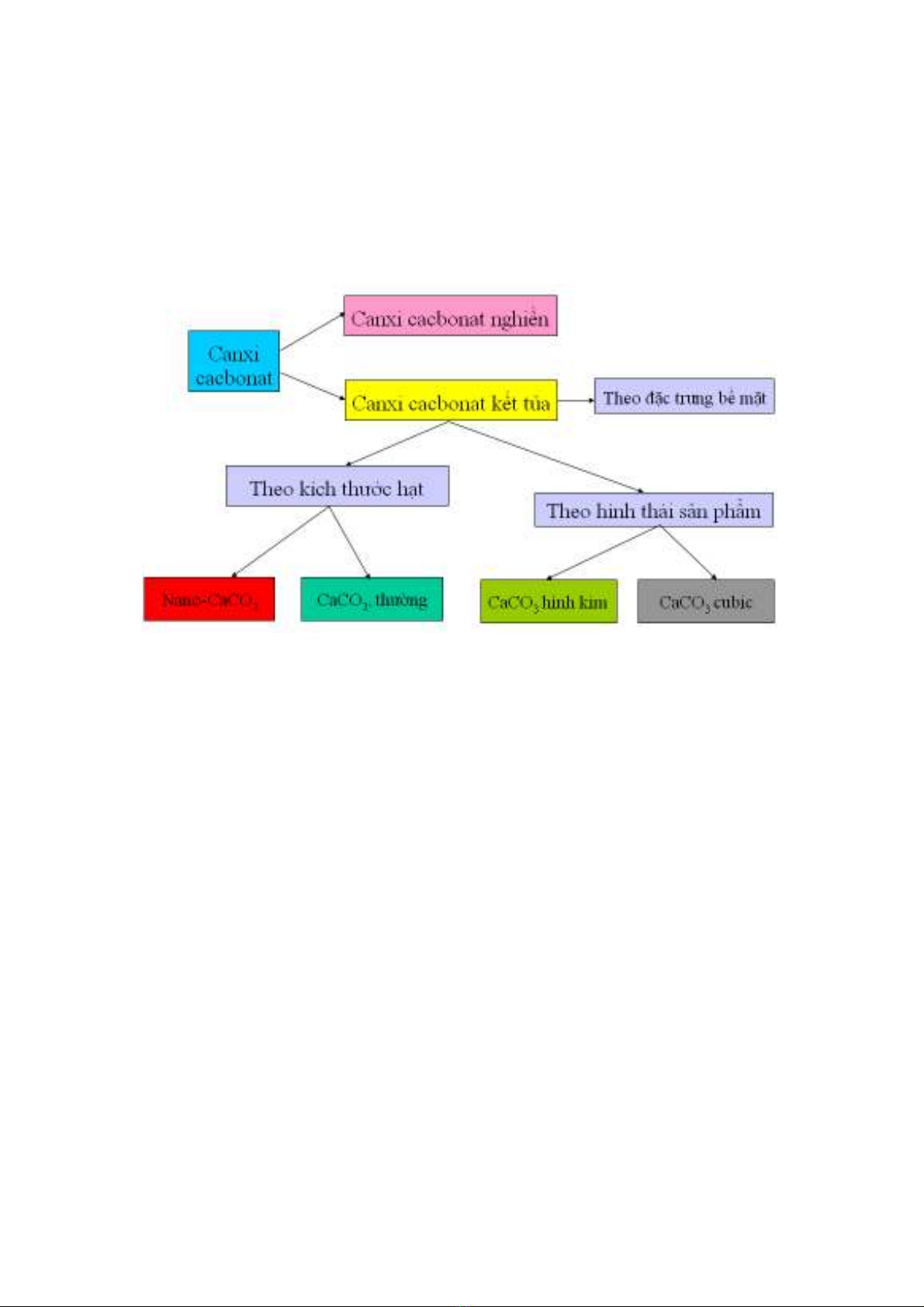
Tùy theo t ng khía c nh đánh giá và ng lĩnh v c s d ng, canxi cacbonatừ ạ ứ ự ử ụ
đc chia ra thành nhi u lo i khác nhau nh hình 1.1. ượ ề ạ ư
Hình 1.1. Phân lo i canxi cacbonatạ
1.2. NG D NG C A CANXI CACBONATỨ Ụ Ủ
Canxi cacbonat đc s d ng ch y u trong công nghi p ượ ử ụ ủ ế ệ v i s l ng l nớ ố ượ ớ
nh : làm ch t đn trong công nghi p s n xu t gi y, ch t đn cho cao su, kemư ấ ộ ệ ả ấ ấ ấ ộ
đánh răng, ch t d o, s n, d c ph m, m ph m, keo dán… ấ ẻ ơ ượ ẩ ỹ ẩ
Ngoài các ng d ng đã nêu trên, nano-PCC có các u đi m n i tr i so v iứ ụ ở ư ể ổ ộ ớ
PCC truy n th ng do vi c t o ra đc các hình d ng, kích th c khác nhau và đề ố ệ ạ ượ ạ ướ ộ
phân b kích th c h t trong d i h p. ố ướ ạ ả ẹ
Hi n nay, ng i ta đã s n xu t đc 4 lo i hình thái h c đc tr ng c aệ ườ ả ấ ượ ạ ọ ặ ư ủ
PCC, đó là: d ng hình kim, hình lăng tr (prismatic), hình kh i (cubic), hình n hoaạ ụ ố ơ
h ng (scalenohedral). M i lo i PCC v i hình d ng, kích th c khác nhau đu cóồ ỗ ạ ớ ạ ướ ề
các tính ch t v t lý riêng bi t, đc ch n cho phù h p v i các lĩnh v c ng d ngấ ậ ệ ượ ọ ợ ớ ự ứ ụ
khác nhau.
1.3. CÁC PH NG PHÁP CHÍNH ĐI U CH VÀ BI N TÍNH CaCOƯƠ Ề Ế Ế 3 KÍCH
TH C NANO MÉTƯỚ
1.3.1. Các ph ng pháp chính CaCOươ 3 kích th c nano mét.ướ
1.3.1.1. Ph ng pháp đi u ch CaCOươ ề ế 3 truy n th ng.ề ố
1.3.1.2. Ph ng pháp cacbonat hóa s a vôi trong h micell đo. ươ ữ ệ ả
1.3.1.3. Ph ng pháp đi u ch nano-CaCOươ ề ế 3 b ng thi t b kênh ph n ng vi mô -ằ ế ị ả ứ
MTMCR.
1.4. PH NG PHÁP K T T A TR NG TR NG CAO ƯƠ Ế Ủ Ọ ƯỜ
3

Ph ng pháp k t t a tr ng tr ng cao là ph ng pháp mà ph n ng hóa h cươ ế ủ ọ ườ ươ ả ứ ọ
x y ra trong môi tr ng tr ng l c cao, m t b ph n chính c a thi t b là b quayả ườ ọ ự ộ ộ ậ ủ ế ị ộ
RPB (rotating packed bed) có tác d ng t o ra tr ng tr ng cao h n nhi u l n tr ngụ ạ ọ ườ ơ ề ầ ọ
tr ng c a trái đt. ườ ủ ấ
1.4.1. Nguyên lý c b n c a ph ng pháp k t t a tr ng tr ng cao trong quáơ ả ủ ươ ế ủ ọ ườ
trình t ng h p v t li u nanoổ ợ ậ ệ
Nguyên lý c b n c a ph ng pháp k t t a tr ng tr ng cao là các ch tơ ả ủ ươ ế ủ ọ ườ ấ
tham gia ph n ng ti p xúc v i nhau trong kho ng th i gian r t ng n nh t c đả ứ ế ớ ả ờ ấ ắ ờ ố ộ
khu y tr n vi mô mãnh li t quy mô phân t , ph n ng k t t a x y ra trong môiấ ộ ệ ở ử ả ứ ế ủ ả
tr ng tr ng l c cao. Ch t l ng khi vào b quay RPB đc chia tách ra thành cácườ ọ ự ấ ỏ ộ ượ
màng l ng v i đ dày c micro mét trên ph n b m t trong c a RPB và ph n ngỏ ớ ộ ỡ ầ ề ặ ủ ả ứ
x y ra t i đây. ả ạ
Ph n ng t ng h p nano-CaCOả ứ ổ ợ 3 bao g m 3 b c chính: ph n ng hóa h c,ồ ướ ả ứ ọ
t c đ t o m m và phát tri n tinh th .ố ộ ạ ầ ể ể
- Ph n ng hóa h c:ả ứ ọ
A+B = P
- S t o m m:ự ạ ầ
P +P+ …+P = P*
- S phát tri n tinh th :ự ể ể
P*+P = P1
P1+ P = P2
………....
Pn-1+P = Pn
Trong đó: A, B là ch t ph n ng, P là s n ph m ph n ng, Pấ ả ứ ả ẩ ả ứ * là m m tinhầ
th , Pể1, P2,...,Pn, là các kích th c khác nhau c a tinh th .ướ ủ ể
M t dung d ch có n ng đ quá bão hòa cao, đ phân b n ng đ đng đuộ ị ồ ộ ộ ố ồ ộ ồ ề
trong thi t b và th i gian phát tri n tinh th là nh nhau cho toàn b các tinh th làế ị ờ ể ể ư ộ ể
đi u ki n c n thi t cho vi c t ng h p b t nano có đ phân b kích th c h t h p.ề ệ ầ ế ệ ổ ợ ộ ộ ố ướ ạ ẹ
N u ta g i tế ọ n là th i gian t lúc t o đc các m m tinh th đng đu đuờ ừ ạ ượ ầ ể ồ ề ầ
tiên cho t i lúc t c đ t o m m n đnh thì theo Dirksen và Ring [ớ ố ộ ạ ầ ổ ị 13] tn đc tínhượ
theo công th c 1ứ.1:
tn = 6d2n*/(DlnS) (1.1)
Trong đó: d là đng kính c a phân t , nườ ủ ử * là s l ng ion trong m t m mố ượ ộ ầ
tinh th , D là h s khu ch tán, S là t l gi a n ng đ quá bão hòa chia cho n ngể ệ ố ế ỉ ệ ữ ồ ộ ồ
đ bão hòa c a dung d ch. Trong dung d ch n c tộ ủ ị ị ướ n có giá tr nh h n 1ms.ị ỏ ơ
Theo tài li u [ệ23, 28] thì khu y tr nấ ộ quy mô phân t ử(micromixing) và khu yấ
tr n ộvĩ mô (macromixing) có nh h ng r t l n đn đ phân b kích th c h tả ưở ấ ớ ế ộ ố ướ ạ
trong ph n ng gi a BaClả ứ ữ 2 và Na2SO4. Trong quy mô l n ớthì khu y tr n ấ ộ vĩ mô có
th t o ra đc s phân b n ng đ đng đu c a các ch t ph n ngể ạ ượ ự ố ồ ộ ồ ề ủ ấ ả ứ , còn v i quyớ
mô phân t thì đ phân b n ng đ đng đu trong thi t b ch có th đt đcử ộ ố ồ ộ ồ ề ế ị ỉ ể ạ ượ
b i khu y tr n ở ấ ộ vi mô ởquy mô phân tử m t cách mãnh li tộ ệ , c khu y tr n ả ấ ộ vi mô
và khu y tr n ấ ộ vĩ mô x y ra đng th i trong thùng ph n ng. ả ồ ờ ả ứ Khu y tr n ấ ộ vi mô là
4

y uế t quy t đnh m c đ quá bão hòa c a ch t tan và s phân b n ng đ đngố ế ị ứ ộ ủ ấ ự ố ồ ộ ồ
đu trong vùng ph n ng c a thi t b quy mô phân t .ề ả ứ ủ ế ị ở ử
T nh ng quan đi m c a k thu t ph n ng hóa h c trên thì t c đ ph nừ ữ ể ủ ỹ ậ ả ứ ọ ố ộ ả
ng và t c đ t o m m c a ph n ng hóa h c ch b nh h ng b i n i đng h cứ ố ộ ạ ầ ủ ả ứ ọ ỉ ị ả ưở ở ộ ộ ọ
c a các ch t tham gia ph n ngủ ấ ả ứ mà không b nh h ng b i khu y tr n ị ả ưở ở ấ ộ vi mô
trong vùng τm < tn. Khi τm > tn thì t c đ ph n ng và t c đ t o m m s ch u nhố ộ ả ứ ố ộ ạ ầ ẽ ị ả
h ng c a khu y tr n ưở ủ ấ ộ vi mô. đây Ởτm là th i gian đc tr ng c a ờ ặ ư ủ khu y tr n viấ ộ
mô t lúc b t đu khu y tr n cho t i lúc tr ng thái khu y tr n là c c đi m cừ ắ ầ ấ ộ ớ ạ ấ ộ ự ạ ở ứ
đ phân t . ộ ử
Do t c đ t o m m trong vùng ph n ng c a thi t b r t không đng đu.ố ộ ạ ầ ả ứ ủ ế ị ấ ồ ề
Vì v y, chúng ta nên t o ra đc s khu y tr n ậ ạ ượ ự ấ ộ vi mô mãnh li t đ đt đc ệ ể ạ ượ τm <
tn. Trong vùng τm < tn thì t c đ t o m m t i các đi m khác nhau trong thi t b g nố ộ ạ ầ ạ ể ế ị ầ
nh b ng nhau và do đó kích th c c a s n ph m đng đu h n hay đ phân bư ằ ướ ủ ả ẩ ồ ề ơ ộ ố
kích th c h t là h p h n.ướ ạ ẹ ơ
Th i gian ờτm đc tính theo ph ng trình ượ ươ 1.2 [39]:
2/1
)/(
mm k
(1.2)
Trong đó: Km là h ng s có giá tr 16, ằ ố ị ε là t c đ tiêu hao năng l ng, ố ộ ượ ν là
đ nh t đng h c, ộ ớ ộ ọ ví d trong thi t b ph n ng thông th ng đi v i dung d chụ ế ị ả ứ ườ ố ớ ị
n c thì ướ ε = 0,1-10 w/kg, ν = 10-6 m2.s-1 trọng tr ng h p này thì ườ ợ τm = 5-50 ms l nớ
h n r t nhi u l n tơ ấ ề ầ n = 1ms đi u này nói lên r ng s phân b kích th c h t khóề ằ ự ố ướ ạ
ki m soát. ểKhu y tr n vi môấ ộ ít nh h ng t i t c đ phát tri n tinh th ch cóả ưở ớ ố ộ ể ể ỉ
khu y tr n vĩ môấ ộ có nh h ng l n t i t c đ phát tri n tinh thả ưở ớ ớ ố ộ ể ể, vì v y tinh thậ ể
s đng đuẽ ồ ề hay đ phân b kích th c h t d i h pộ ố ướ ạ ở ả ẹ n u chúng ta t o đc m tế ạ ượ ộ
môi tr ng ườ có khu y tr n vĩ môấ ộ t t trong vùng phát tri n tinh th .ố ể ể
D a vào nh ng phân tích trên đ t o ra đc m t thi t b t ng h p b tự ữ ở ể ạ ượ ộ ế ị ổ ợ ộ
nano có đ phân b kích th c h p và có th đi u khi n đc hình thái c a h tộ ố ướ ẹ ể ề ể ượ ủ ạ
c n các đi u ki n c b n sau: a) vùng ph n ng và vùng t o m m tách bi t v iầ ề ệ ơ ả ả ứ ạ ầ ệ ớ
vùng phát tri n tinh th ; b) vùng ể ể phát tri n tinh thể ể có khu y tr n vĩ môấ ộ t t; c) l uố ư
l ng vào vùng ph n ng và t o m m là dòng ch y ượ ả ứ ạ ầ ả đu, ềc kh i (bao g m cả ố ồ ả
l ng và r n), t đó ta th y m t thi t b ph n ng t i u là có đc m t vùngỏ ắ ừ ấ ộ ế ị ả ứ ố ư ượ ộ ph nả
ng và t o m m có khu y tr n vi mô mãnh li tứ ạ ầ ấ ộ ệ và m t vùng phát tri n tinh th ộ ể ể có
khu y tr n vĩ môấ ộ t t v i dòng ch y ố ớ ả đu, n đnhề ổ ị .
Trong RPB t c đ chuy n kh i và t c đố ộ ể ố ố ộ khu y tr n vi môấ ộ l n h n nhi u soớ ơ ề
v i các thi t b thông th ngớ ế ị ườ , do đó s t o ra đc m t n ng đ quá bão hòa caoẽ ạ ượ ộ ồ ộ
c a s n ph m trong ph n ng k t t a, b quay RPB là s k t h p gi a khu y tr nủ ả ẩ ả ứ ế ủ ộ ự ế ợ ữ ấ ộ
đng và khu y tr n tĩnh. Giá tr ộ ấ ộ ị τm trong RPB kho ng 10-100 µs nh h n r t nhi uả ỏ ơ ấ ề
giá tr tịn = 1 ms đi u này th a mãn yêu c u ề ỏ ầ τm < tn do đó đ phân b kích th c h tộ ố ướ ạ
và hình thái h c c a h t có th đi u khi n đc. Theo nh ng phân tích trên thìọ ủ ạ ể ề ể ượ ữ ở
thi t b ph n ng tr ng tr ng cao là lý t ng đ t ng h p kh i l ng l n b tế ị ả ứ ọ ườ ưở ể ổ ợ ố ượ ớ ộ
nano có đ phân b kích th c h t h p. ộ ố ướ ạ ẹ
1.4.2. T ng h p nano-CaCOổ ợ 3 b ng ph ng pháp higeeằ ươ
5


























