Giới thiệu tài liệu
Chương 12 trình bày về dung dịch điện ly, bao gồm hệ số đẳng trương Vant' Hoff, độ điện ly, cân bằng trong dung dịch điện ly yếu và khó tan, ảnh hưởng của ion đến độ tan, và điều kiện hòa tan/kết tủa.
Đối tượng sử dụng
Sinh viên và những người nghiên cứu về hóa học dung dịch, đặc biệt là dung dịch điện ly.
Nội dung tóm tắt
Chương này đi sâu vào các khái niệm và định luật liên quan đến dung dịch điện ly.
1. **Hệ Số Đẳng Trương (i)**: Giới thiệu hệ số Vant' Hoff (i) để so sánh số tiểu phân chất tan giữa dung dịch điện ly và dung dịch phân tử. Khi chất điện ly phân ly hoàn toàn (α = 1), i bằng số ion tạo thành từ một phân tử (m). Các định luật Raoult và Van't Hoff được áp dụng cho dung dịch điện ly, nhấn mạnh sự khác biệt về áp suất hơi, nhiệt độ sôi, nhiệt độ đông đặc và áp suất thẩm thấu so với dung dịch phân tử.
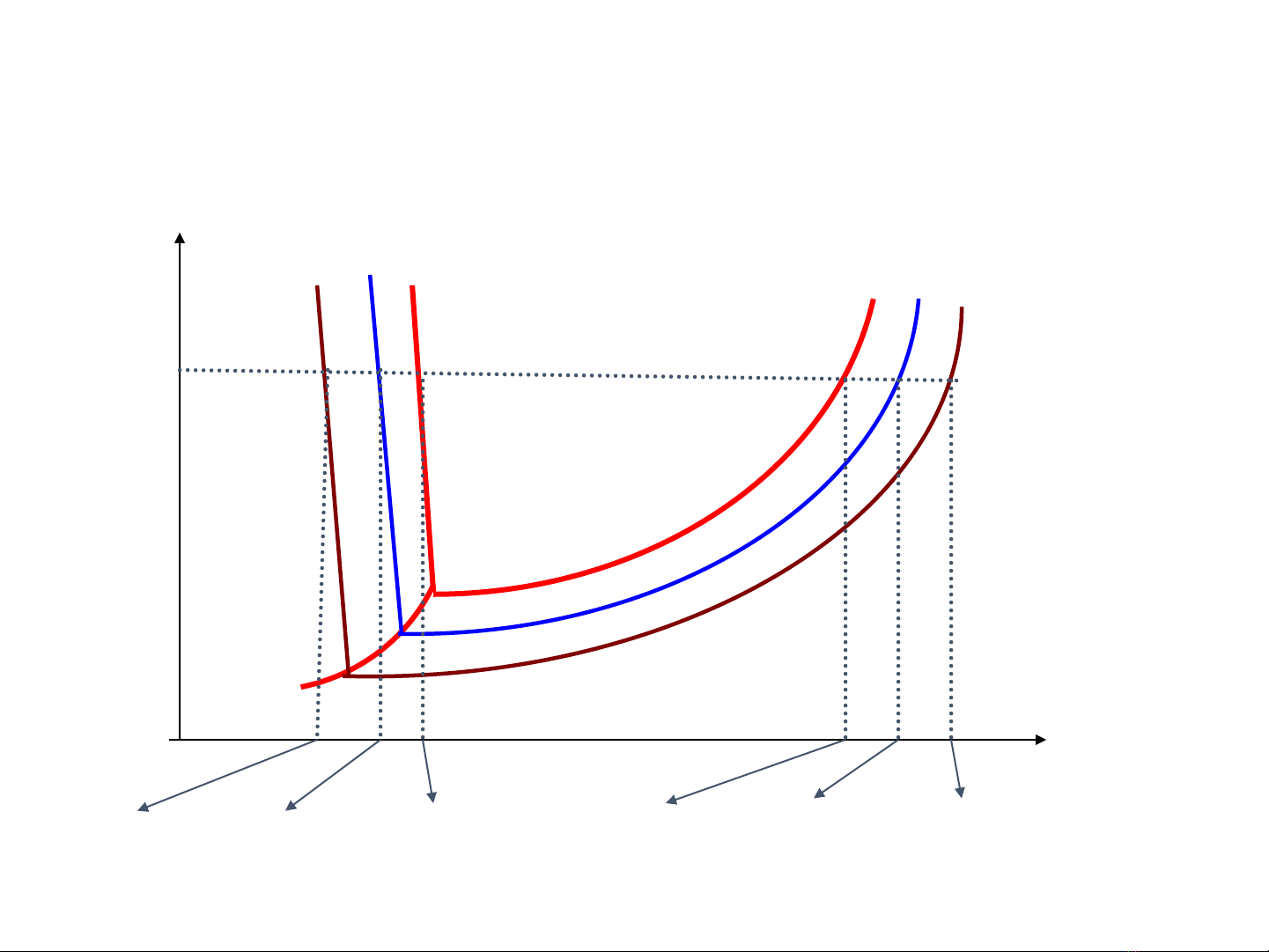
2. **Độ Điện Ly (α)**: Trình bày khái niệm độ điện ly (α), một thước đo mức độ phân ly của chất tan trong dung dịch. Công thức tính α và cách đánh giá độ mạnh yếu của chất điện ly dựa trên giá trị α trong dung dịch nước 0,1N ở 25°C cũng được đề cập.
3. **Cân Bằng Trong Dung Dịch Điện Ly Yếu**: Thảo luận về cân bằng hóa học trong dung dịch chất điện ly yếu, bao gồm hằng số điện ly (K) và mối quan hệ giữa K và α. Định luật pha loãng Ostwald được giới thiệu để mô tả sự thay đổi của α theo nồng độ.
4. **Các Yếu Tố Ảnh Hưởng Đến Độ Điện Ly (α)**: Các yếu tố như độ phân cực của chất tan và dung môi, hằng số điện môi của dung môi, nồng độ dung dịch và nhiệt độ ảnh hưởng đến độ điện ly như thế nào.
5. **Cân Bằng Trong Dung Dịch Chất Điện Ly Khó Tan**: Nghiên cứu cân bằng trong dung dịch chất điện ly khó tan, bao gồm tích số tan (T) và độ tan (S). Ảnh hưởng của ion cùng loại và ion khác loại đến độ tan của chất điện ly khó tan cũng được phân tích, cùng với các điều kiện để hòa tan hoặc kết tủa chất điện ly.