
HYDROCACBON THƠM (1)
(AROMATIC HYDROCARBONES)
1. Khái niệm
2. Danh pháp
2. Cấu trúc
2. Điều chế

1. KHÁI NIỆM
Hợp chất được gọi là “thơm” là do các chất đầu tiên người ta
biết về dãy này thực sự có mùi thơm.
❖Khái niệm Hợp chất thơm
CH2-OH
CH2COOCH3
CH=CH-CH2-OH
Ancol benzylic có trong
tinh dầu hoa hồng
Este benzylaxetat có
trong tinh dầu hoa nhài
Ancol cinnamic có trong
tinh dầu hoa dạ hương
Hợp chất thơm là các hợp chất mạch vòng, có cấu trúc
electron đặc biệt và là những hợp chất hữu cơ có tính thơm.
Hợp chất có tính thơm là hợp chất có những đặc điểm sau đây:
-Tính bền vững của vòng về mặt nhiệt động, đặc trưng bởi năng
lượng thơm hóa Ep.
-Dễ tham gia phản ứng thế ở nhân thơm, Khó tham gia phản
ứng cộng và phản ứng oxy hóa;
-Phản ứng thế xảy ra có quy luật; các nhóm thế ở vòng có ảnh
hưởng rất đặc trưng đến tính chất hóa học của hợp chất.
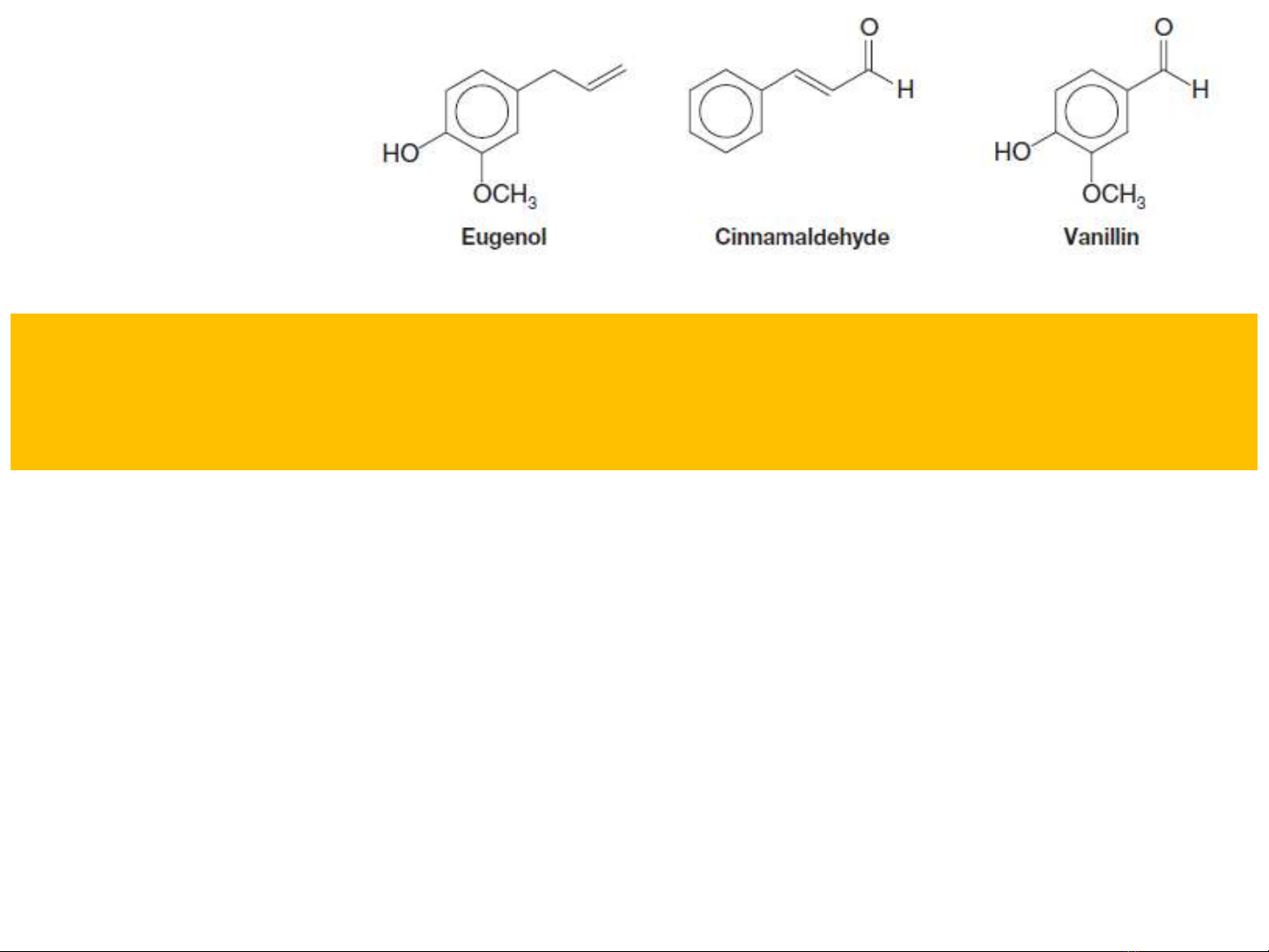
Có trong tinh dầu: đinh hương quế vanilla

Hợp chất thơm là các hợp chất mạch vòng, có cấu trúc
electron đặc biệt và là những hợp chất hữu cơ có tính thơm.
Về mặt cấu trúc, hợp chất phải có những điều kiện sau để
có tính thơm :
-Là hệ vòng liên hợp kín giải toả electron ptrên toàn hệ
thống;
-Vòng thơm phải có cấu trúc phẳng, không nhất thiết
giống benzen (có thể là đa vòng thơm hoặc dị vòng thơm);
- Các electron pphải cặp đôi và số electron p phải thoả
mãn quy tắc của Hückel là quy tắc được thiết lập dựa trên
phương pháp hóa lượng tử).
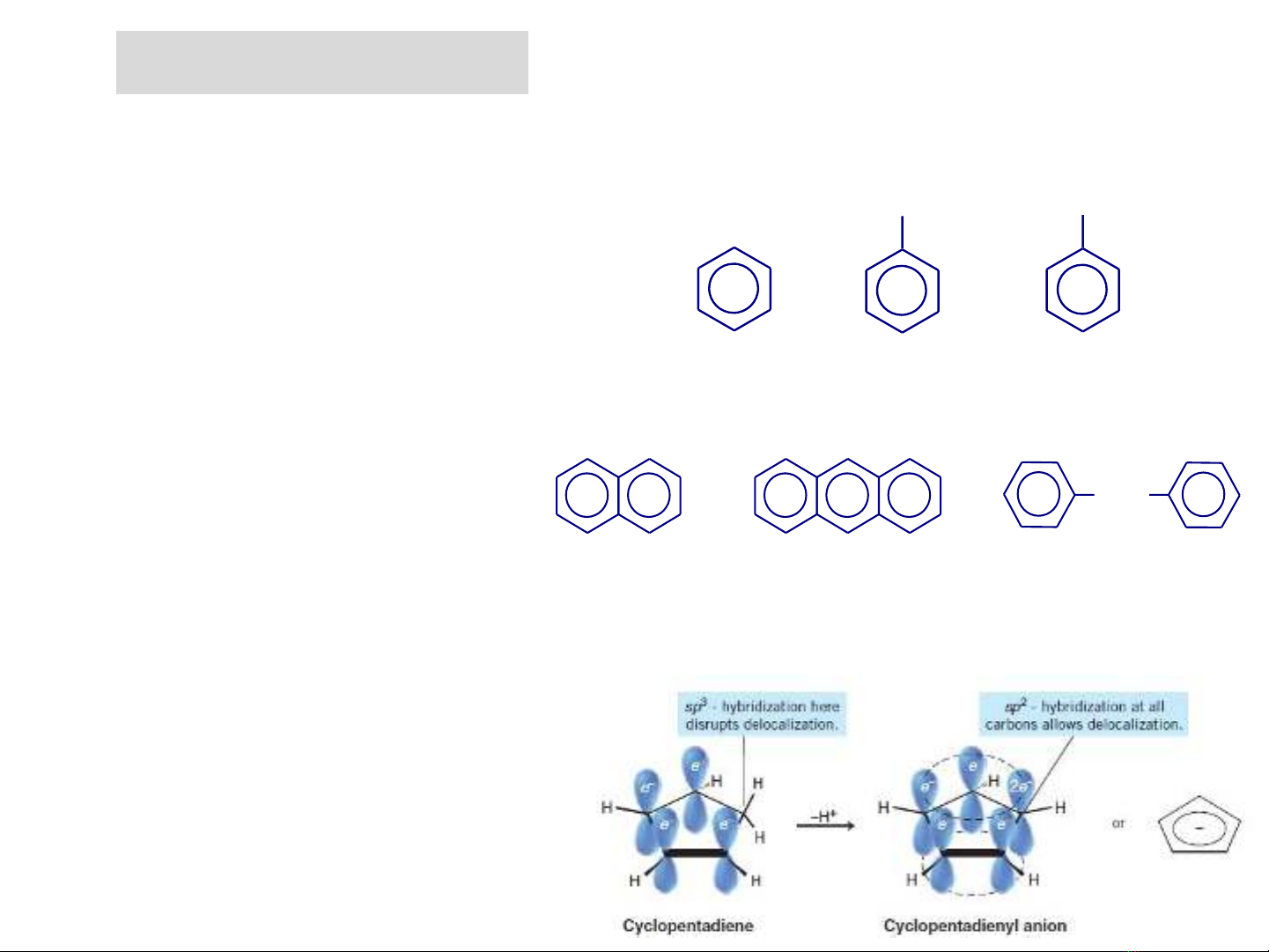
❖Phân loại
+ Hydrocacbon thơm có chứa vòng benzen;
- Hydrocacbon dãy benzen
- Hydrocacbon đa nhân thơm
Diphenylmetan
CH2
AnthraxenNaphtalen
+ Hydrocacbon thơm không chứa
vòng benzene: là các hợp chất
đơn vòng nhưng số electron p
thoả mãn công thức Hückel, do có
(4n+2) electron p giải toả trên một
vòng phẳng nên các hợp chất này
đều có tính thơm.
CH3 CH = CH2
Benzene Toluene Styrene




![Bài giảng Hóa hữu cơ 1: Phần 2 - ĐH Võ Trường Toản (GV. Nguyễn Hoàng Sơn) [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230606/loivokiet/135x160/802300288.jpg)


![Bài giảng Hóa hữu cơ 1: Phần 1 - ĐH Võ Trường Toản (GV. Lê Vinh Bảo Châu) [Chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230606/loivokiet/135x160/1932011819.jpg)


















