
TRƯỜNG ĐẠI HỌC VÕ TRƯỜNG TOẢN
KHOA DƯỢC
____________________
BÀI GIẢNG
LÝ THUYẾT HÓA HỮU CƠ
(SV Y KHOA)
Hậu Giang, 2021

5
MỤC
LỤC
CHƯƠNG 1
:
Cấu
trúc điện
tử
của
nguyên
tử
carbon
và
sự tạo
thành các liên kết
trong
hợp
chất
hữu
cơ
1
1. Cu trúc điện tử (electron) ca nguyên tử carbon 1
2. Sự tạo thành các liên kết 3
CHƯƠNG 2: Các hiệu
ứng
điện
tử
trong
hóa
hữu
cơ
12
1. Hiệu ng cảm ng 12
2. Hiệu ng liên hợp (cộng h
ư
ng) 15
CHƯƠNG
3
:
Cấu
trúc
phân
tử các chất
hữu
cơ. Đồng phân
và
cấu dạng 17
1. Đng phân phẳng 17
2. Đng phân lập thể - đng phân không gian 19
CHƯƠNG
4
:
Khái
niệm
acid
-base
trong
hóa
hữu
cơ
33
1. Khái niệm acid -base theo Bronsted-Lowry (1923) 33
2. Khái niệm acid -base theo Lewis (1923) 35
3. Yếu tố ảnh hưng đến tính acid -base ca cht hữu cơ 35
CHƯƠNG
5
:
Các
loại
phản
ứng
trong
hóa
hữu
cơ
và
khái
niệm
về
cơ
chế
phản
ứng
36
1. Các loại phản ng trong hóa hữu cơ 36
2. Khái niệm về cơ chế phản ng 38
CHƯƠNG
6
:
Alkan
-
Hydrocarbon
no
1. Ngun gốc thiên nhiên - Cu tạo, đng phân, cu dạng 48
2. Danh pháp 50
3. Phương pháp điều chế alkan 51
4. Tính cht lý học 53
5. Tính cht hóa học 54
6. Cht điển hình 85
CHƯƠNG
7
:
Cycloalk58
1. Monocycloalkan 60
2. Hợp cht đa vòng 65
CHƯƠNG
8:
Alken
-
Hydrocarbon
etylenic
67
1. Cu tạo ca alken 67
2. Đng phân 67
3. Danh pháp 69
4. Phương pháp điều chế 70
5. Tính cht lý học 74
6. Tính cht hóa học 75
7. Cht điển hình 83
CHƯƠNG
9
:
Alkyn
-
Hydrocarbon
acetylenic
85
1. Cu trúc điện tử 85
2. Danh pháp và đng phân 86
3. Phương pháp điều chế 86

6
4. Tính cht lý học 88
5. Tính cht hóa học 88
6. Cht điển hình 92
CHƯƠNG
10
:
Aren
-
Hydrocarbon
thơm
94
1. Benzen và nhân thơm 94
2. Danh pháp và đng phân 95
3. Phương pháp điều chế 96
4. Tính cht lý học 97
5. Tính cht hóa học 98
CHƯƠNG
11
: H
ydrocarbon
đa
nhân
thơm
111
1. Cu tạo và danh pháp 111
2. Biphenyl 112
3. Biphenylmetan và triphenylmetan 114
4. Naphtalen 115
5. Anthracen 117
6. Phenanthren 118
CHƯƠNG 12
:
Hệ
thống
liên hợp
và
alkadien
120
1. Hệ thống allylic 120
2. Dien 123
3. Hệ thống liên hợp bậc cao 126
4. Phản ng Diels –Alder 127
CHƯƠNG
13
:
Dẫn
xuất
halogen
130
1. Danh pháp 130
2. Đng phân 131
3. Phương pháp điều chế 131
4. Tính cht lý học 135
5. Tính cht hóa học 135
CHƯƠNG
14
:
Hợp chất
cơ
kim
142
1. Cu tạo 142
2. Danh pháp 142
3.Tính cht lý học 143
4. Phương pháp điều chế các hợp cht cơ kim 143
5. Các phản ng ca hợp cht cơ kim 145
CHƯƠNG
15
:
Alcol
150
Monoalcol 150
CHƯƠNG
16
:
Phenol
162
1. Monophenol 162
2. Polyphenol 170
CHƯƠNG
17
:
Ether
174
1. Ether mạch h 174
2. Ether mạch vòng 178
1
1 1
C
hương
1
CẤU TRÚC ĐIỆN TỬ CỦA NGUYÊN TỬ CARBON
VÀ SỰ TẠO THÀNH CÁC LIÊN KẾT
TRONG HỢP CHẤT HỮU CƠ
MỤC TIÊU
1.
Trình bày được cấu tạo điện tử carbon ở các trạng thái lai hóa sp3, sp2 và sp.
2.
Giải thích đ
ư
ợc cách hình thành các loại liên kết:
−
Cộng hóa trị
−
Liên kết phối trí
−
Liên kết hydro
NỘI
DUNG
1.
CẤU
TRÚC
ĐIỆN
TỬ
(ELECTRON)
CỦA
NGUYÊN
TỬ
CARBON
1.1.
Thuyết
carbon tứ diện
(Vant Hoff- Le Bel 1874)
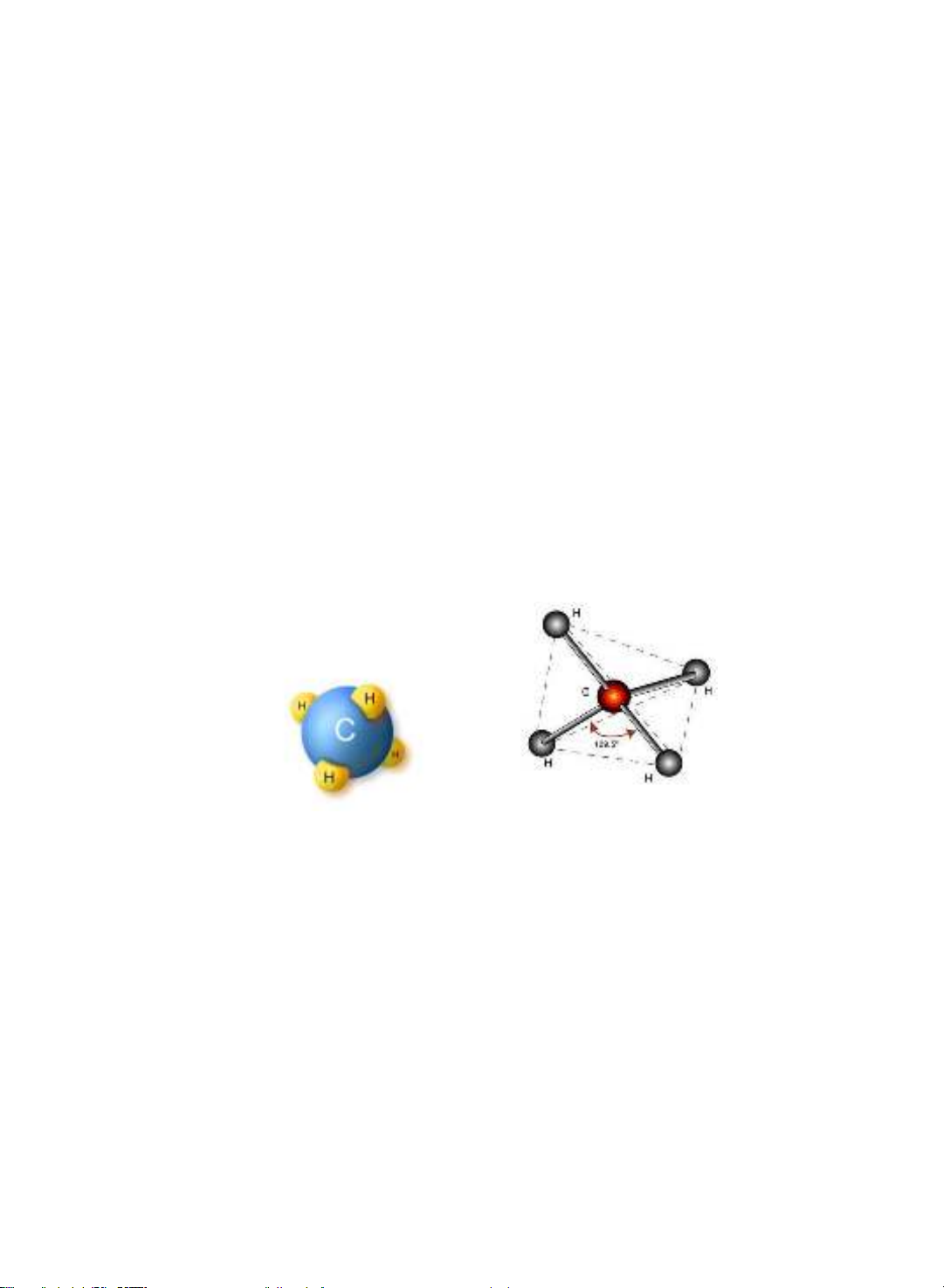
Nguyên tử carbon có 4 hóa trị. Bốn hóa trị ca carbon hướng ra bốn đỉnh ca
một t diện. Tâm ca t diện là nguyên tử carbon.
Các góc hóa trị tâm đều bằng nhau và bằng 109°28'. Khi nguyên tử carbon
liên kết với 4 nguyên tử hoặc 4 nhóm thế đng nht ta đ
ư
ợc một t diện đều.
1.2.
Cấu trúc điện tử của nguyên tử
carbon
1.2.1.
Carbon
ở
trạng
thái
cơ
bản
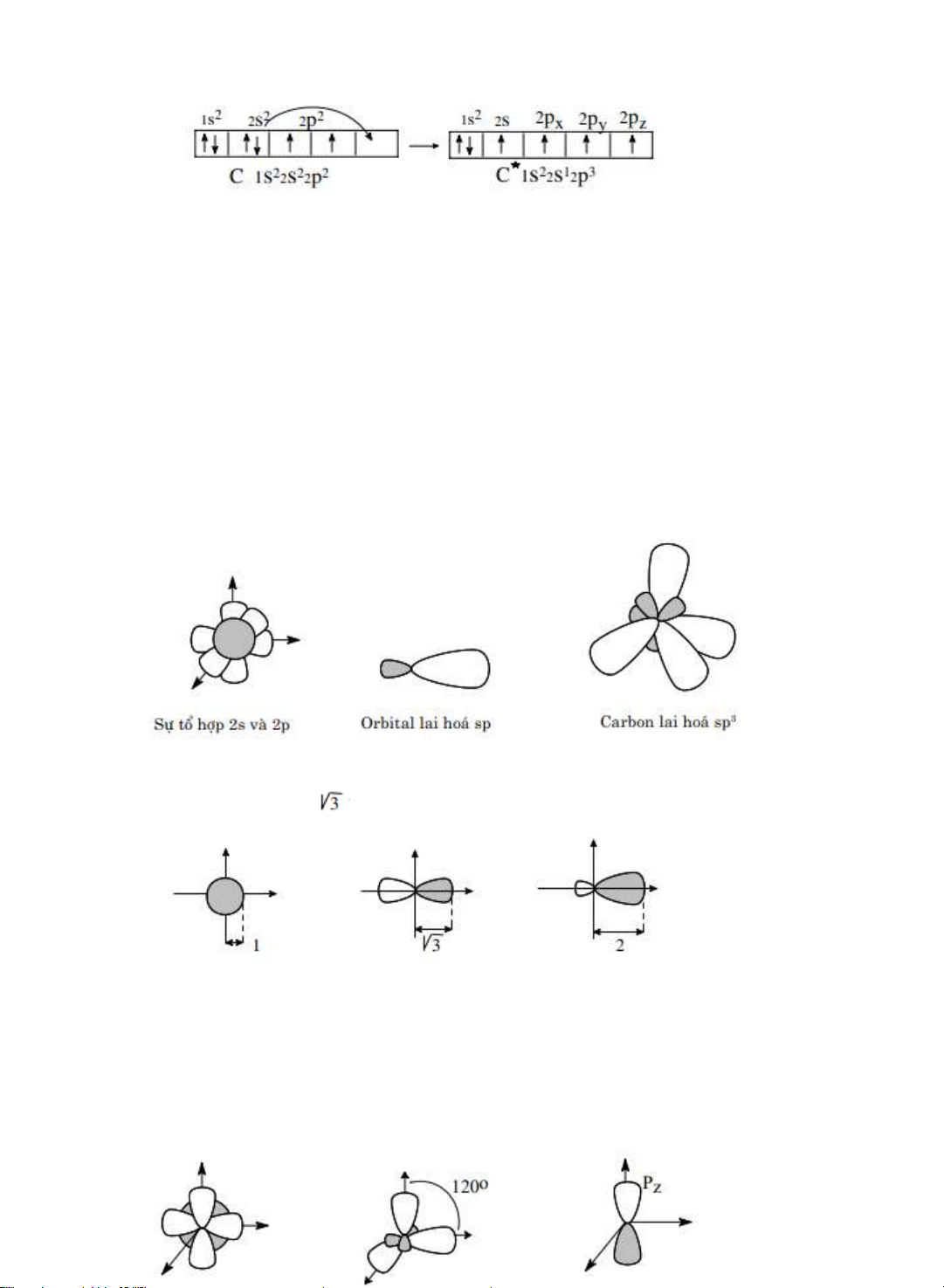
Carbon có có cu hình điện tử C 1s 2s 2px2py
1s2 2s2 2p2
2 điện tử đơn độc là px và py. Còn có một orbital 2pz trống không có điện tử
1.2.2.
Carbon
ở
trạng
thái
kích
thích
C
*
1s2 2s1 2s3 ≡ 1s2 2s2 2px12py12pz1
2
Carbon hp thu năng lượng 60-70 kcal/mol, một điện tử 2s2 chuyển lên trạng
thái 2p (orbital 2pz)
Carbon có cu hình điện tử 1s22s12p3 là carbon kích thích (1s22s12px2py2pz).
Kết quả là carbon có 4 điện tử đơn độc tạo liên kết. Carbon luôn có hóa trị 4.
Bốn điện tử ca carbon kích thích có năng lượng khác nhau do đó các liên kết ca
carbon phải khác nhau. Thực tế phân tử metan có 4 liên kết C - H hoàn toàn giống
nhau .
1.2.3.
Carbon
ở
trạng
thái
lai
hóa
Khi
tạo
thành
các
liên
kết,
orbital
2s
và
một
số
orbital
2p
có
thể
t
hợp
lại
tạo thành những orbital có dạng khác các orbital ban đu và có khả năng xen ph
cao hơn do đó liên kết được hình thành cũng bền hơn. Sự t hợp đó được gọi là sự
lai hóa.
•
Lai hóa sp3
Kiểu lai hóa th nht gọi là lai hoá sp3 (còn gọi là lai hóa t diện).
Một orbital 2s và 3 orbital p t hợp với nhau tạo thành 4 orbital lai hóa sp3.
Các kết quả tính toán cho thy rằng nếu xem khả năng xen ph ca orbital
s là 1 thì ca orbital p là
và ca orbital sp3 là 2.
Lai hóa sp2.
Sự t hợp orbital 2s với 2 orbital 2p (2px, 2py) tạo thành 3 orbital lai hóa sp2
hay
còn
gọi
là
lai
hóa
tam
giác.
Trc
đối
xng
ca
3
orbital
sp2
nằm
trong
một
mặt
phẳng
và
tạo
nên
những
góc
120°.
Khả
năng
xen
ph
tương
đối
ca
orbital
sp2 là 1,99.



![Bài giảng Hóa hữu cơ 1: Phần 2 - ĐH Võ Trường Toản (GV. Nguyễn Hoàng Sơn) [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230606/loivokiet/135x160/802300288.jpg)


![Bài giảng Hóa hữu cơ 1: Phần 1 - ĐH Võ Trường Toản (GV. Lê Vinh Bảo Châu) [Chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230606/loivokiet/135x160/1932011819.jpg)



















