
Ch ng I ươ
NGUYÊN LÝ M T C A NHI T Ộ Ủ Ệ
ĐNG H C VÀ NHI T HÓA H CỘ Ọ Ệ Ọ
I. Các khái ni m và đnh nghĩa ệ ị
II. Nguyên lý th nh t c a nhi t đng l c h c ứ ấ ủ ệ ộ ự ọ
III. Đnh lu t Hessị ậ
IV. Nhi t dungệ
V. nh h ng c a nhi t đ đn hi u ng nhi t Ả ưở ủ ệ ộ ế ệ ứ ệ
c a ph n ng – Đnh lu t Kirchhoffủ ả ứ ị ậ

GI I THI U Ớ Ệ
Nhi t hóa h c là khoa h c nghiên c u ệ ọ ọ ứ
HI U NG NHI T c a các quá trình hoá h c.Ệ Ứ Ệ ủ ọ
Nhi m v c a nhi t hoá h c ệ ụ ủ ệ ọ
Nghiên c u đ ứ ể TÍNH TOÁN ĐNH L NGỊ ƯỢ
HI U NG NHI TỆ Ứ Ệ c a các quá trìnhủ
C s lý thuy t c a nhi t hóa h c ơ ở ế ủ ệ ọ
nguyên lý I c a nhi t đng l c h c ủ ệ ộ ự ọ
các đnh lu t có liên quanị ậ (đnh lu t Hess,ị ậ
đnh lu t Kirchhoff).ị ậ
05/18/22 2
607010 - Ch ng 1ươ
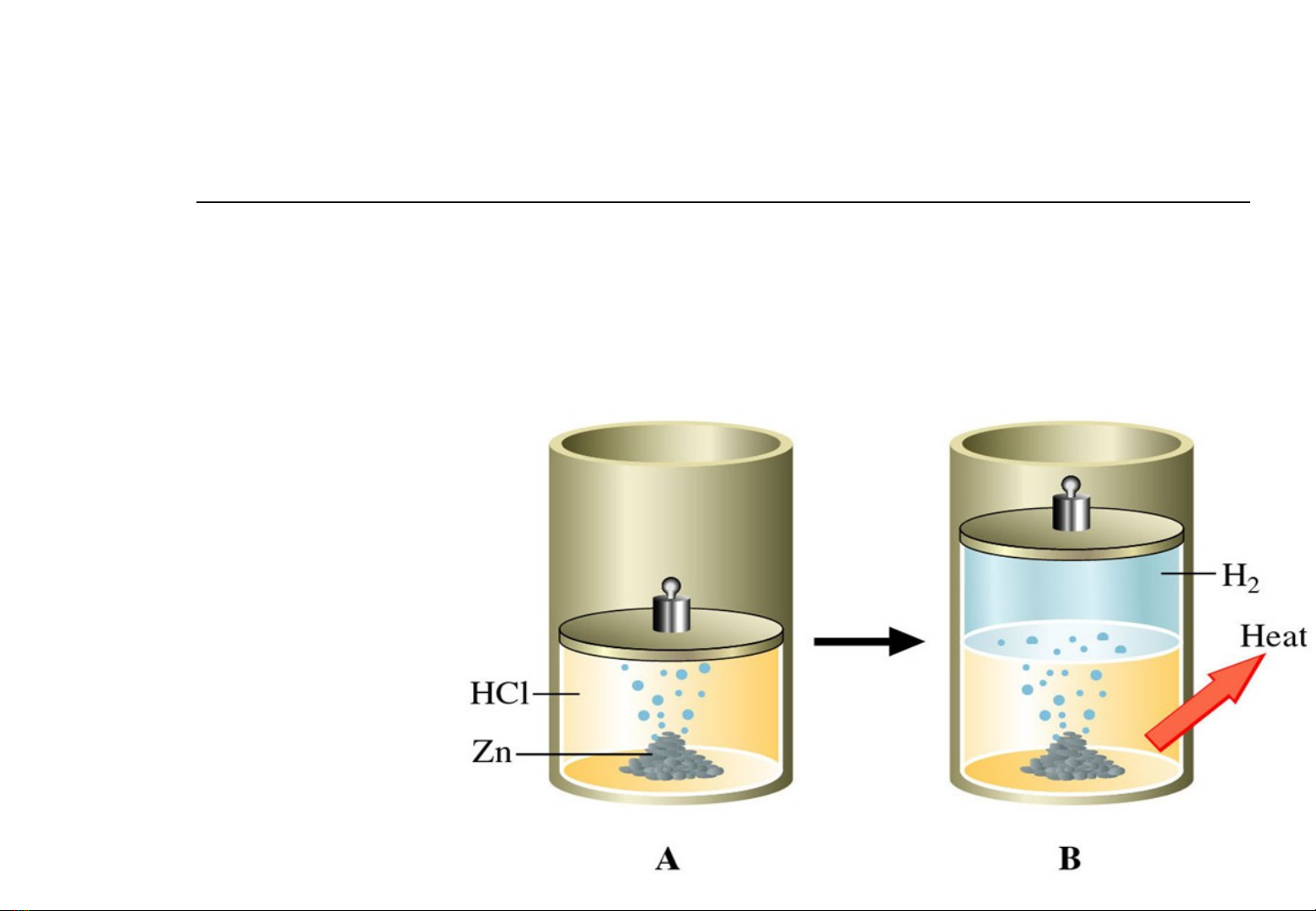
I. CÁC KHÁI NI M VÀ ĐNH NGHĨAỆ Ị
H :Ệ là ph n v t ch t vĩ mô đc gi i h n đ ầ ậ ấ ượ ớ ạ ể
nghiên c u ứ
MÔI TR NG:ƯỜ là ph n th gi i xung quanh h .ầ ế ớ ệ
Môi tr ng và h ườ ệ
có th t ngể ươ
tác ho c không ặ
t ng tác v i nhau. ươ ớ
05/18/22 3
607010 - Ch ng 1ươ

H NHI T ĐNG:Ệ Ệ Ộ
là h đã ệ ở tr ng thái cân b ngạ ằ (là tr ng thái mà ạ
các tính ch t c a h không thay đi theo th i ấ ủ ệ ổ ờ
gian khi môi tr ng không tác đng đn h )ườ ộ ế ệ
còn g i là ọH CÂN B NGỆ Ằ
H VĨ MÔ:Ệ
là h g m m t s r t l n các ti u phân (h t) mà ệ ồ ộ ố ấ ớ ể ạ
ta có th áp d ng các quy lu t xác su t và th ng ể ụ ậ ấ ố
kê.
05/18/22 4
607010 - Ch ng 1ươ

PHÂN LO I HẠ Ệ
H MỆ Ở
H ĐÓNGỆ
H CÔ L PỆ Ậ
H ĐO N NHI TỆ Ạ Ệ
theo t ng tác gi a h và môi tr ng ươ ữ ệ ườ
(tính ch t trao đi ch t và năng l ng)ấ ổ ấ ượ
05/18/22 5
607010 - Ch ng 1ươ









![Bài giảng Hóa lý thực phẩm [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250716/kimphuong1001/135x160/849_bai-giang-hoa-ly-thuc-pham.jpg)
![Bài giảng Hóa lý 1: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250704/tiepnguyen438@gmail.com/135x160/6631751621117.jpg)
![Bài tập Vật lý sóng: Tổng hợp bài tập 6 [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250805/oursky04/135x160/401768817575.jpg)














