
1
Khí động lực học
Dòng không nhớt nén được

2
Phương trình cơ bản
Khí lý tưởng
R=287J/(kg.K)
RTp
3
Nội năng-entanpy
Tổng năng lượng mole của toàn bộ khối
khí gọi là nội năng.
Nội năng tính cho đơn vị khối lượng KH
e liên hệ với entanpy (e): h=e+pv
Đối với khí hoàn hảo (pefect gaz) thì nội
năng và entanpy phụ thuộc vào nhiệt độ:
e=e(T), h=h(T)
de=cvdT; dh=cpdT

4
Nội năng-entanpy
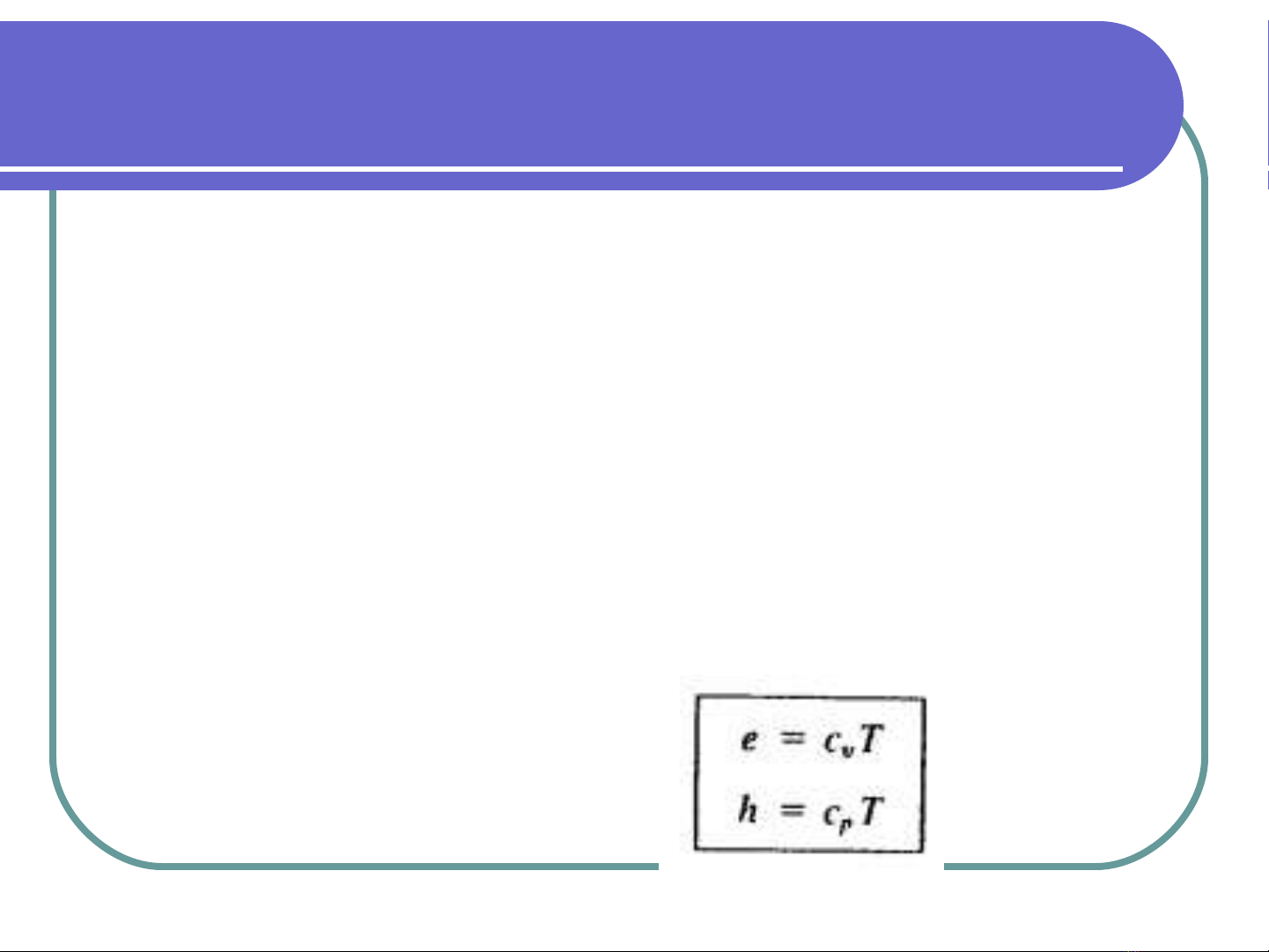
cv, cp là nhiệt dung đẳng tích và đẳng áp
Với khí hoàn hảo: e=cvT, h=cpT
Cp-cv=R
1
;
1
;
R
c
R
c
c
c
vp
v
p
4.1
Đối với khí tiêu chuẩn
5
Định luật nhiệt động học thứ nhất
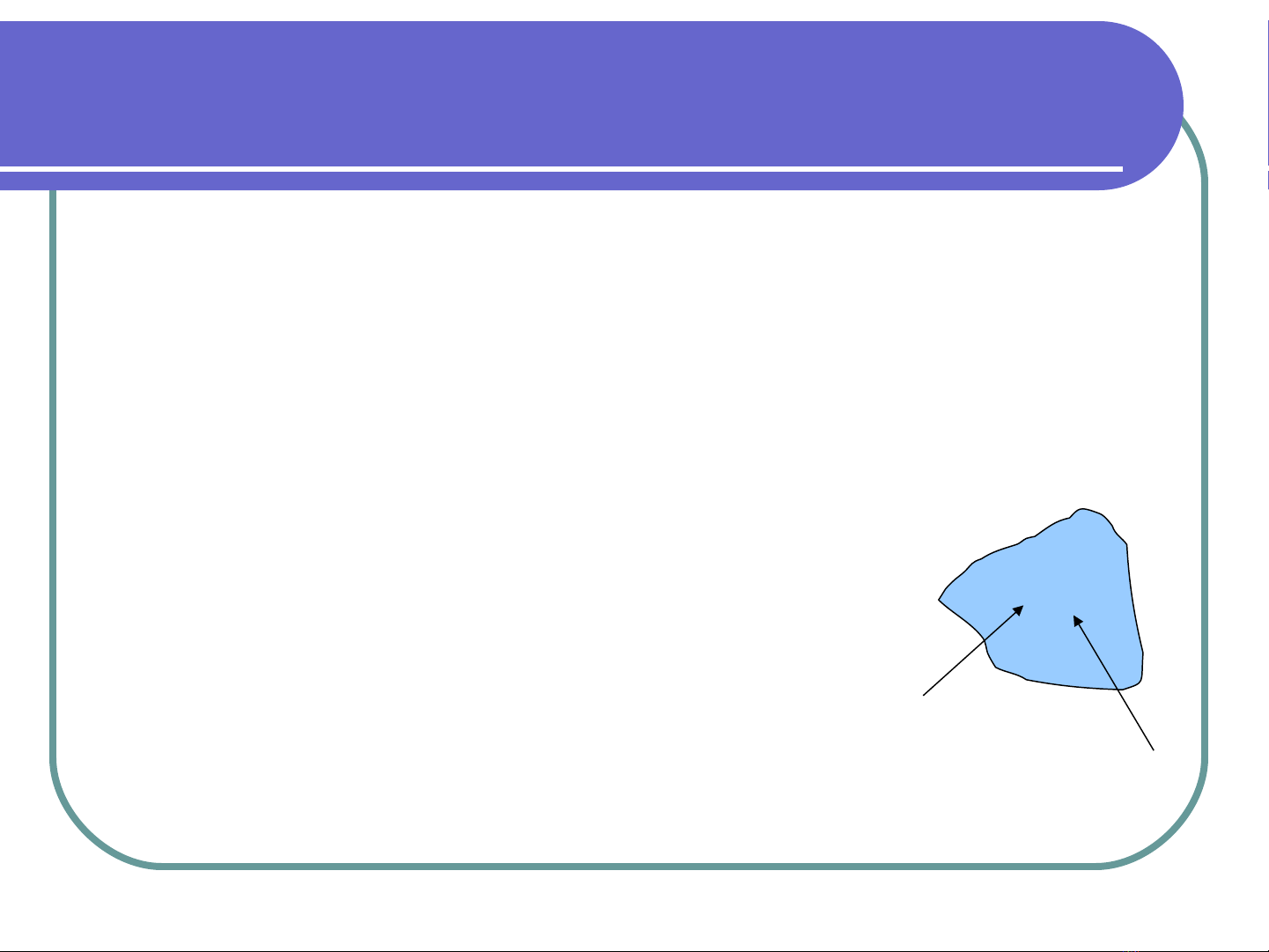
Với một hệ như hình vẽ δq là nhiệt trao đổi
trong và ngoài hệ, δw công sinh ra bởi hệ
thống, sự thay đổi nội năng trong khối de:
δw
δq
dewq
Đó là định luật 1 của nhiệt động lực học

![Câu hỏi ôn tập môn Mô phỏng [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250702/kimphuong555/135x160/5491751421721.jpg)
























