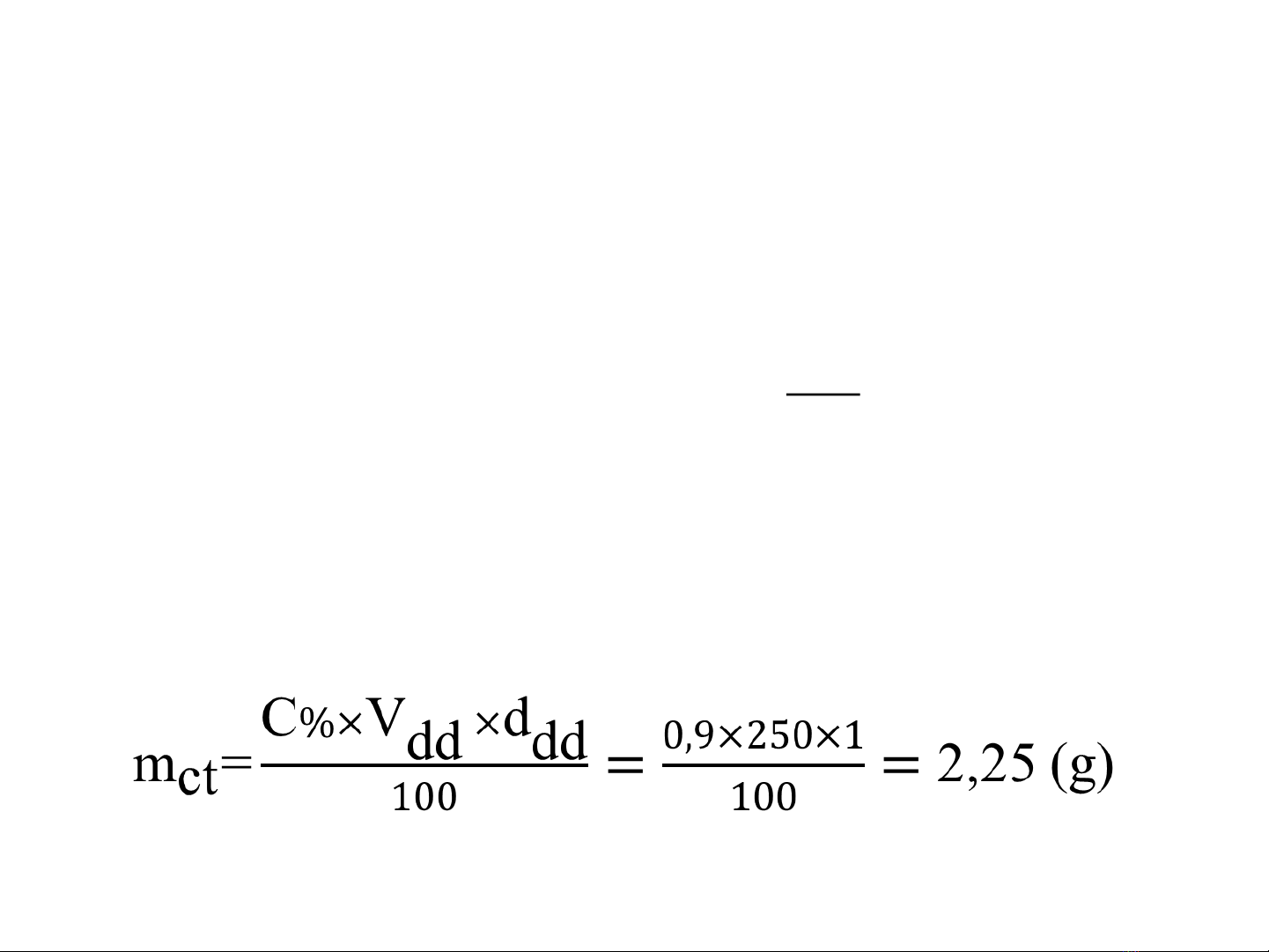Giới thiệu tài liệu
Bài giảng Nồng độ dung dịch là mẫu bài giảng chỉ rõ khái niệm về nồng độ dung dịch, cách biểu thị và tính toán nồng độ, từ cơ bản đến phức tạp hơn. Bài giảng đưa ra các ví dụ concretes để trình bày cách áp dụng các công thức và quan tâm đến hệ thức liên hệ giữa nồng độ phần trăm và nồng độ mol.
Đối tượng sử dụng
Sinh viên, Nhà nghiên cứu về hóa học
Nội dung tóm tắt
Bài giảng Nồng độ dung dịch bao gồm 10 phần, mỗi phần tập trung vào một khái niệm khác nhau về nồng độ dung dịch, từ định nghĩa đến các công thức tính toán. Phần 1 chỉ ra rõ tại sao nồng độ dung dịch quan trọng trong hóa học và phân tích. Phần 2 giới thiệu các đơn vị nồng độ và tính toán khảo sát đơn vị nồng độ mol. Phần 3 cho biết cách chuyển đổi giữa nồng độ phần trăm và nồng độ mol, với hệ thức liên hệ giữa chúng. Phần 4 trình bày về các loại kết quả của một phân tích hoá hóa, như nồng độ phân tử, nồng độ ion, và nồng độ solute. Phần 5 cho biết cách chuyển đổi giữa nồng độ phân tử, nồng độ ion, và nồng độ solute. Phần 6 quan tâm đến các công thức của hệ quả trong hóa học, bao gồm các công thức phân tích và công thức chuyển đổi. Phần 7 cho biết cách xác định nồng độ solute trong một hỗn hợp dung dịch, bằng cách sử dụng công thức phân tích và công thức chuyển đổi. Phần 8 quan tâm đến các loại hỗn hợp dung dịch, như hỗn hợp một phân tử (homogeneous), hỗn hợp không phân tán (heterogeneous), và hỗn hợp ion. Phần 9 cho biết cách xác định nồng độ ion trong một hỗn hợp dung dịch, bằng cách sử dụng công thức phân tích và công thức chuyển đổi. Phần 10 quan tâm đến những vấn đề khắt khe trong hóa học, như sự cố ánh xạ đáp ứng, sự phân tán của một chất trong dung dịch, và sự tạo thành của một chất kết hợp. Bài giảng có rất nhiều ví dụ concretes để minh họa cách áp dụng các công thức và quan tâm đến những vấn đề khắt khe trong hóa học.