Truonghocso.com – Mạng xã hội học tập tốt nhất Việt Nam!
Trường học số - luôn nỗ lực mang lại những điều tốt nhất!
CHUYÊN ĐỀ KIM LOẠI TÁC DỤNG VỚI DUNG DỊCH MUỐI
I. ĐỊNH NGHĨA CHUNG
- Dạng toán về kim loại tác dụng với muối là dạng toán rất hay gặp trong bài thi đại học. Đây là 1 dạng
toán không khó nếu nắm chắc về phần đại cương của kim loại và dãy điện hóa của kim loại để nắm rõ
quy luật biến đổi về tính oxi hóa và tính khử của các cặp oxi hóa khử.
- Khi giải bài tập về phần này thì trước tiên các bạn phải xác định xem nó thuộc dạng nào trong số những
dạng sau để mình có thể có hướng giải và phương pháp giải nhanh nhất:
+ Dạng 1: Bài tập về 1 kim loại tác dụng với 1 muối
+ Dạng 2: Bài tập về 1 kim loại tác dụng với hỗn hợp muối
+ Dạng 3: Bài tập về hỗn hợp kim loại tác dụng với 1 muối
+ Dạng 4: Bài tập về hỗn hợp kim loại tác dụng với hỗn hợp muối
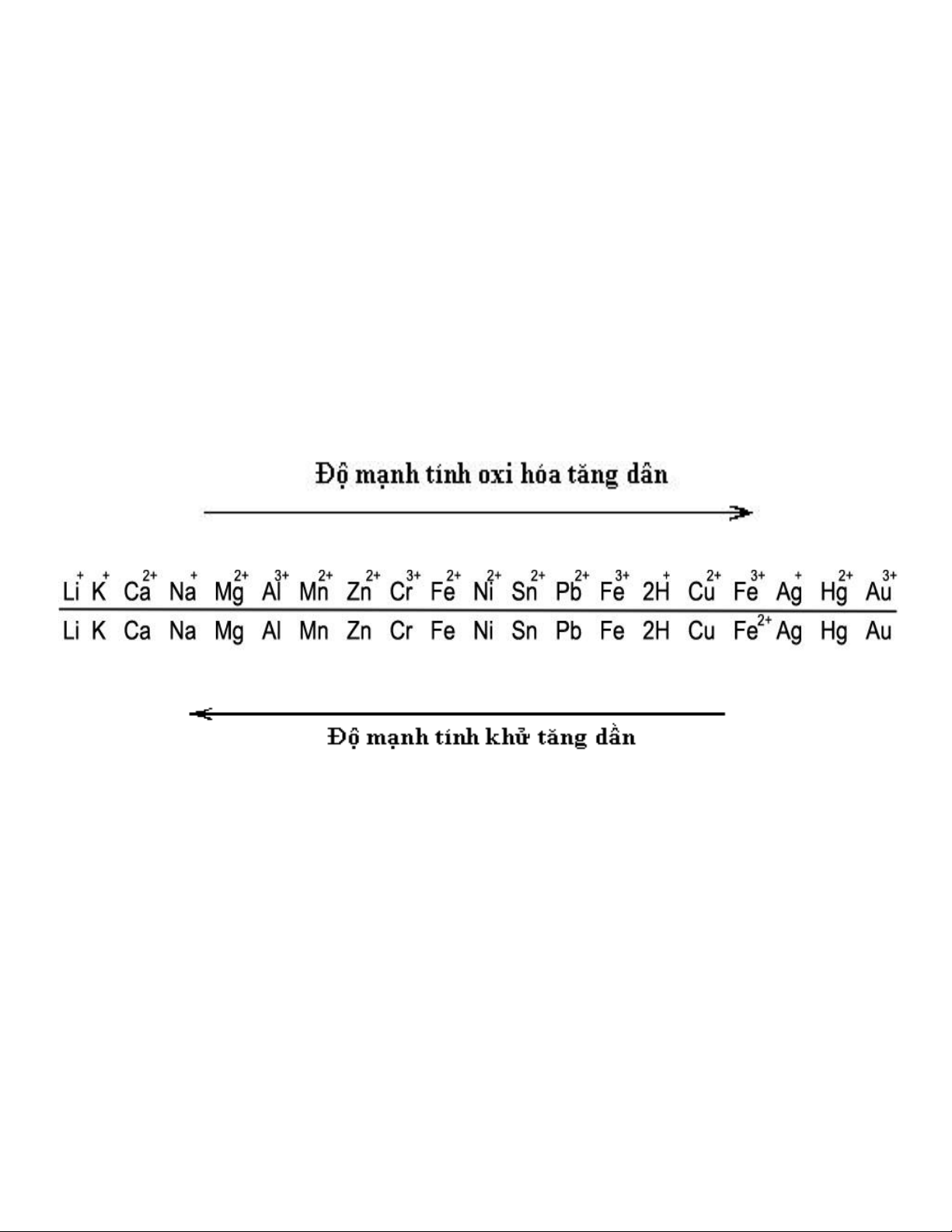
- Nguyên tắc chung để giải bài toán này là: Kim loại có tính khử mạnh hơn sẽ tác dụng với muối mà có
gốc cation kim loại có tính oxi hóa mạnh hơn. Và quy luật oxi hóa khử theo dãy sau:
Vì vậy khi giải bài toán dạng này phải xác định xem kim loại nào phản ứng với muối nào trước.
Và điều kiện để kim loại X đẩy kim loại Y khỏi dung dịch muối là X phải đứng trước Y trong dãy điện
hóa.
- Các phương pháp giải nhanh thường áp dụng cho bài toán về phần này đó là: tăng giảm khối lượng, bảo
toàn e và bảo toàn khối lượng.
Lƣu ý:
+ Nếu bài cho kim loại kiềm hay kiềm thổ tác dụng với dung dịch muối thì không bao giờ được cho kim
loại kiềm hay kiềm thổ đẩy kim loại trong muối. Đầu tiên kim loại kiềm, kiềm thổ tác dụng với nước
trước tạo bazo sau đó bazo đó tác dụng với muối của kim loại trong dung dịch tạo kết tủa hidroxit kim
loại đó ( nếu hidroxit đó là chất không tan ). Lúc này kết tủa không phải kim loại trong dung dịch mà là
hidroxit của kim loại trong muối ban đầu. Nhiều bạn không nắm vững tính chất nên hay sai phần này.
+ Khi bài toán cho kim loại Fe vào dung dịch AgNO3 thì có các TH:
TH1: Nếu AgNO3 thiếu hoặc vừa đủ thì chỉ xảy ra pứ:
Fe + 2AgNO3 → 2Ag + Fe(NO3)2 (1)

Truonghocso.com – Mạng xã hội học tập tốt nhất Việt Nam!
Trường học số - luôn nỗ lực mang lại những điều tốt nhất!
TH2: Nếu AgNO3 dư thì xáy ra phản ứng
Fe + 3AgNO3 → Fe(NO3)3 + 3Ag
Phương trình này là kết hợp của 2 phương trình:
Fe + 2AgNO3 → 2Ag + Fe(NO3)2
Nếu sau phản ứng trên mà AgNO3 còn dư thì theo dãy điện hóa ở trên thì xáy ra phản ứng:
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
II. CÁC DẠNG TOÁN THƢỜNG GẶP
1. BÀI TOÁN: MỘT KIM LOẠI TÁC DỤNG VỚI MỘT MUỐI
a) Phƣơng pháp giải
- Dạng bài tập này đơn giản nhất trong 4 dạng bài tập về kim loại tác dụng với muối vì không phải
biện luận chia trường hợp mà áp dụng bình thường theo phương trình. Bài hỏi gì mình làm cái đó.
- Phương pháp giải thường là áp dụng phương pháp tăng giảm khối lượng.
Phương trình tổng quát: kim loạitan + muối
Muối mới + kim loại mớibám
+ Nếu đề bài cho khối lượng lá kim loại tăng hay giảm là m thì áp dụng như sau:
Khối lương lá kim loại tăng lên so với trước khi nhúng ta có:
mkim loại bám vào - mkim loại tan ra = mtăng
Khối lương lá kim loại giảm so với trước khi nhúng ta có:
mkim loại tan ra - mkim loại bám vào = mgiảm
+ Nếu đề bài cho khối lượng lá kim loại tăng hay giảm là x% thì ta áp dụng như sau:
Khối lương lá kim loại tăng lên x% so với trước khi nhúng ta có:
m kim loại bám vào - mkim loại tan ra = mbđ*
100
x
Khối lương lá kim loại giảm xuống x% so với trước khi nhúng ta có:
mkim loại tan ra - mkim loại bám vào = mbđ*
100
x
Với mbđ là khối lượng ban đầu của thanh kim loại hoặc đề sẽ cho sẵn khối lượng kim loại ban đầu.
b) Bài tập ví dụ
Ví dụ 1: Ngâm một đinh sắt trong 200ml dung dịch CuSO4. Sau khi phản ứng kết thúc lấy đinh sắt ra
khỏi dung dịch rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 1,6gam. Nồng độ ban đầu của
CuSO4 là bao nhiêu mol/l?

Truonghocso.com – Mạng xã hội học tập tốt nhất Việt Nam!
Trường học số - luôn nỗ lực mang lại những điều tốt nhất!
HƢỚNG DẪN GIẢI:
Nếu ai học chắc phương pháp tăng giảm khối lượng thì nhẩm được ngay:
nCuSO4 =
1,6 0, 2
64 56 mol
. ⇒ [CuSO4] = 1M
Bạn nào chưa nắm vững phương pháp tăng giảm khối lượng thì có thể giải theo cách đại số sau:
Gọi số mol CuSO4 phản ứng là x
Fe + CuSO4 → FeSO4 + Cu
x x x
Theo đề bài ta có: mCu
baùm
- mFe
tan
= mFe
taêng
64x - 56x = 1,6 ⇒ x = 0,2 mol ⇒ [CuSO4] = 1M
Ví dụ 2: Nhúng thanh kim loại M vào 100ml dung dịch FeCl2 0,5M. Sau khi phản ứng hoàn toàn khối
lượng thanh kim loại giảm 0,45g. Kim loại M là:
A. Al B. Mg C. Zn D. Cu
HƢỚNG DẪN GIẢI:
Phân tích bài toán: Vì đề bài yêu cầu xác định kim loại mà chưa cho hóa trị, các đáp án chỉ có Al là hóa
trị III, do đó để giải quyết bài toán đơn giản hơn ta có thể giả sử kim loại M có hóa trị II để giải, nếu tìm
không phải kim loại hóa trị II ta chọn đáp án Al. Còn nếu đề bài cho các kim loại có hóa trị biến đổi từ I
đến III, khi đó ta giải trường hợp tổng quát với n là hóa trị của kim loại M.
Giả sử kim loại có hóa trị II
Số mol của FeCl2: n = CM.V = 0,5 . 0,1 = 0,05 mol
Phương trình hóa học: M + FeCl2
MCl2 + Fe
Mol: 0,05 <----0,05--------------------> 0,05mol
Theo đề bài ta có: mM
tan
- mFe
baùm
= mM
giaûm
0,05.M - 56.0,05 = 0,45
Giải ra M = 65 (Zn)
Ví dụ 3: Nhúng một thanh kim loại M hóa trị II nặng m gam vào dung dịch Fe(NO3)2 thì khối lượng
thanh kim loại giảm 6 % so với ban đầu. Nếu nhúng thanh kim loại trên vào dung dịch AgNO3 thì khối
lượng thanh kim loại tăng 25 % so với ban đầu. Biết độ giảm số mol của Fe(NO3)2 gấp đôi độ giảm số
mol của AgNO3 và kim loại kết tủa bám hết lên thanh kim loại M. Kim loại M là:
A. Pb B. Ni C. Cd D. Zn
HƢỚNG DẪN GIẢI:

Truonghocso.com – Mạng xã hội học tập tốt nhất Việt Nam!
Trường học số - luôn nỗ lực mang lại những điều tốt nhất!
Phân tích bài toán: Bài toán này mình chỉ biết kim loại M hóa trị II mà chưa biết số mol của M phản
ứng trong mỗi trường hợp. Đề bài cho thêm 2 dữ kiện là khối lượng thanh kim loại tăng giảm bao nhiêu
% khi nhúng vào 2 dung dịch khác nhau. Như vậy ta có 2 phương trình theo sự tăng giảm khối lượng đó.
Sau đó lập mối quan hệ giữa 2 phương trình để tìm nghiệm.
Gọi nFe 2+pứ = 2x mol → nAg+ pứ = x mol
M + Fe2+ → M2+ + Fe
2x ← 2x → 2x
→ ∆m↓ = 2x.(M – 56) → %mKL giảm =
2 56 .100 6
xM
m
(1)
M + 2Ag+ → M2+ + 2Ag
0,5x x x
→ ∆m↑ = 0,5x.(216 – M) → %mKl tăng =
0,5 216 .100 25
xM
m
(2)
- Từ (1) và (2) ⇒
4 56 6
216 25
M
M
⇒ M = 65 ⇒ Zn
** LƯU Ý: Một số dạng bài toán kim loại tác dụng với dung dịch muối nhưng không phải sau phản ứng
khối lượng thanh kim loại tăng lên hoặc giảm xuống. Dạng toán này thường được cho trong các kỳ thi
Cao đẳng và Đại học và muốn giải được thì các em phải nắm chắc kiến thức cơ bản như: cân bằng phản
ứng oxi hóa khử, xác định chiều của 2 cặp oxi hóa khử, dự đoán được thứ tự phản ứng ra sao.
Ví dụ 1: Cho 6,72 gam Fe tác dụng với 0,4 lít dung dịch HNO3 1M thu được V lít khí NO và dung dịch
X. Cô cạn dung dịch X thu được m gam muối khan. Tính giá trị của m?
HƢỚNG DẪN GIẢI
Phân tích bài toán: Ở đây bài toán cho cả số mol Fe và HNO3 nên phải so sánh xem thằng nào còn dư
và thằng nào phản ứng hết để suy luận có Fe2+ sau phản ứng không.
Cách giải thông thường:
Phương trình hóa học: Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
0,1<---- 0,4 ---------> 0,1
Sau phản ứng: Fedư = 0,12 – 0,1 = 0,02 mol
Trong dung dịch có chứa ion Fe3+ nên tiếp tục xảy ra phản ứng
Fe + 2Fe(NO3)3 → 3Fe(NO3)2 (2)
0,02----->0,04 ------------> 0,06
Dung dịch X gồm: Fe(NO3)2: 0,06 mol, Fe(NO3)3 còn lại: 0,1 – 0,04 = 0,06 mol
Khối lượng muối trong dung dịch X: (180 + 242)*0,06 = 25,32 gam
Cách giải nhanh:

Truonghocso.com – Mạng xã hội học tập tốt nhất Việt Nam!
Trường học số - luôn nỗ lực mang lại những điều tốt nhất!
m muối = mFe + mNO3- tạo muối = 0,12*56 + 0,3*62 = 25,32 gam
Ví dụ 2: Cho 0,01 mol Fe tác dụng vừa đủ với dung dịch chứa 0,025 mol AgNO3, sau phản ứng thu
được chất rắn X và dung dịch Y. Cô cạn dung dịch Y thu được m gam muối khan. Tính giá trị của m?
HƢỚNG DẪN GIẢI:
Phân tích bài toán: Bài toán này cũng cho cả số mol Fe và AgNO3, như vậy ta phải xét xem chất nào dư
và để xem có xảy ra phản ứng: Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag hay không.
Cách giải thông thường:
Phương trình hóa học: Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (1)
0,01---> 0,02 ---------> 0,01----->0,02
Sau phản ứng: AgNO3dư = 0,025 – 0,02 = 0,005 mol
Trong dung dịch có chứa ion Fe2+ lại có ion Ag+ nên tiếp tục xảy ra phản ứng
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag (2)
0,005<------0,005 -----> 0,005
Dung dịch X gồm: Fe(NO3)3: 0,005 mol, Fe(NO3)2 còn lại: 0,01 – 0,005 = 0,005 mol
Khối lượng muối trong dung dịch X: (180 + 242).0,005 = 2,11 gam
Cách giải nhanh:
Ta thấy AgNO3 còn dư sau phản ứng nên dung dịch muối sau phản ứng chỉ chứa gốc NO3- và cation của
Fe nên khối lượng muối bằng khối lượng cation Fe cộng khối lượng gốc NO3-.
m muối = mFe + mNO3- = 0,01*56 + 0,025*62 = 2,11 gam
Ví dụ 3: Cho hỗn hợp X gồm 0,1 mol Fe2O3 và 0,05 mol Cu tác dụng vừa đủ với dung dịch HCl, sau
phản ứng thu được dung dịch Y, cô cạn dung dịch Y thu được m gam muối khan. Tính giá trị của m?
HƢỚNG DẪN GIẢI:
Phân tích bài toán: Hỗn hợp X chứa Fe2O3 và Cu, khi cho vào HCl chắc chắn có phản ứng: Cu + Fe3+
nên ở đây ta chỉ cần quan tâm Cu có bị hòa tan hết hay không.
Cách giải thông thường:
Phương trình hóa học: Fe2O3 + 6HCl → 2FeCl3 + 3H2O (1)
0,1------------------> 0,2
Cu không tác dụng với dung dịch HCl nhưng trong dung dịch tạo thành có chứa ion Fe3+ do đó xảy
ra phản ứng
2FeCl3 + Cu → 2FeCl2 + CuCl2 (2)
0,1<-----0,05 ----->0,1---->0,05



![Chuyên đề nhôm và hợp chất của nhôm: Tổng hợp kiến thức [năm hiện tại]](https://cdn.tailieu.vn/images/document/thumbnail/2020/20200601/nguyenhiensmc/135x160/8891591026255.jpg)






















