GV: PHAN THỊ KIM HẬN Page 1
TRƯỜNG THCS-THPT VÕ NGUYÊN GIÁP ĐỀ KIỂM TRA 1 TIẾT - HKII (2017-2018) (LẦN 1)
TỔ LÍ- HÓA- SINH MÔN : HOÁ HỌC 10
Thời gian: 45 phút(không kể thời gian giao đề)
Họ và tên học sinh:……………………………lớp 10 MÃ ĐỀ 1
PHẦN I: TRẮC NGHIỆM (24 câu-6đ). Học sinh chọn câu trả lời đúng nhất và ghi đáp án vào giấy làm bài
của học sinh. Mỗi câu đúng 0,25đ
Câu 1: Dãy các nguyên tố halogen sắp xếp theo thứ tự Z tăng dần là?
A. F, Cl, Br, At. I B. Cl, F, Br, I, At C. F, Cl, Br. I, At D. F, Cl, I, Br, At
Câu 2: Liên kết trong các phân tử đơn chất halogen là gì?
A. công hóa trị không cực .B. công hóa trị có cực.
C. Liên kết ion. D. Liên kết cho nhận.
Câu 3: Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất halogen (F2, Cl2, Br2, I2)?
A. ở điều kiện thường là chất khí. B. có tính oxi hoá mạnh.
C. tác dụng mạnh với nước. D. vừa có tính oxi hoá, vừa có tính khử.
Câu 4: Cho dãy axit: HF, HCl,HBr,HI. Theo chiều từ trái sang phải tính chất axit biến đổi như sau:
A. giảm. B. vừa tăng, vừa giảm. C. tăng. D. Không đổi
Câu 5: Cho các phát biểu sau:
(a) Tính chất hóa học cơ bản của các halogen là tính oxi hóa mạnh,
(b) Khi đi từ flo đến iot, nhiệt độ sôi và nhiệt độ nóng chảy của các đơn chất halogen tăng dần,
(c) Trong hợp chất, halogen có số oxi hóa: -1, +1, +3, +5, +7,
(d) Trong tự nhiên, hoalogen chủ yếu tồn tại ở dạng đơn chất
(e) Ở điều kiện thường, brom lỏng màu đỏ nâu, dễ bay hơi và bị thăng hoa.
Số phát biểu đúng là
A. 3 B. 1 C. 2 D. 4
Câu 6: Khí HCl có tên gọi là:
A. Axit clohidric B. Hidroclorua C. Axit bromic D. Axit hipoclorơ
Câu 7: Kim loại nào sau đây khi tác dụng với clo và axit clohidric cho cùng một loại muối?
A. Zn. B. Fe. C. Cu. D. Ag
Câu 8: Phản ứng nào sau đây chứng tỏ HCl có tính oxi hóa ?
A. MnO2 + 4HCl → MnCl2+ Cl2 + 2H2O B. Mg(OH)2 + HCl → MgCl2 +2H2O
C. CuO + 2HCl → CuCl2 + H2O D. Zn + 2HCl → ZnCl2 + H2.
Câu 9: Dãy các chất nào sau đây đều tác dụng với axit clohidric?
A. Fe2O3, Cu, Fe, AgNO3. B. KMnO4¸Fe, CuO, AgNO3.
C. Fe, CuO, H2SO4, Ag. D. KMnO4, Fe, H2SO4, Mg(OH)2.
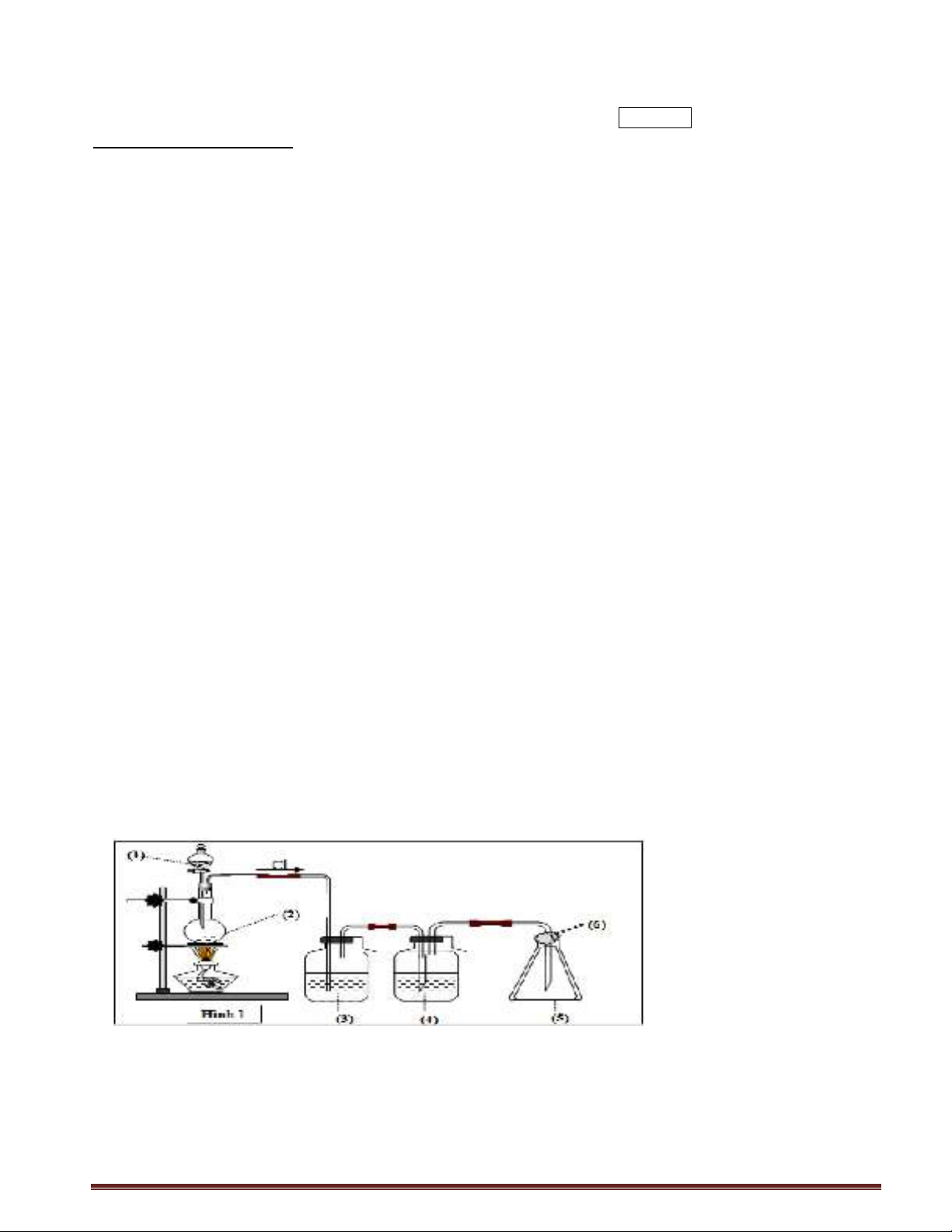
Câu 10: Cho sơ đồ thí nghiệm điều chế và thu khí clo trong phòng thí nghiệm (Hình 1) từ các chất ban đầu là
MnO2 và dung dịch HCl đậm đặc. TN được thực hiện trong điều kiện đun nóng, sẽ có một phần khí HCl bị bay
hơi. Để thu được khí clo sạch bình số (3); (4) sẽ chứa lần lượt các chất nào trong các phương án sau?
A. NaCl bão hòa và H2SO4 đặc. B. NaCl bão hòa và dd NaOH đặc
C. H2SO4 đặc, dd NaOH đậm đặc D. H2SO4 đặc, dd KMnO4.
Câu 11: Cho phản ứng: MnO2 + HCl đặc 0
t
MnCl2 + Cl2 + H2O. Hệ số cân bằng phản ứng là các số tối
giản. Số phân tử HCl là:
A. 16 B. 8 C. 5 D. 4
GV: PHAN THỊ KIM HẬN Page 2
Câu 12: Cho phản ứng sau : Cl2 + 2NaOH loãng → X + Y + H2O . Vai trò của Clo trong phản ứng hóa học
trên là:
A. chất khử B. chất oxi hoá C. Môi trường D. Vừa oxi hoá vừa khử
Câu 13: Nhận biết 3 dung dịch riêng biệt sau: NaCl, NaNO3, HCl bằng hai thuốc thử nào sau đây?
A. quỳ tím, AgNO3 B. Khí HCl, BaCl2 C. H2SO4 đặc, quỳ tím D. Phenolphtalein, quỳ tím.
Câu 14: Nước Gia – ven là hỗn hợp các chất nào sau đây?
A. HCl, HClO, H2O B. NaCl, NaClO, H2O C. NaCl, NaClO3, H2O D. NaCl, NaClO4,H2O
Câu 15: Clorua vôi và nước Giaven đều được ứng dụng rộng rãi trong việc sát khuẩn, tẩy trùng, tẩy trắng..Vậy
hợp chất nào dùng phổ biến hơn, tại sao?
A. Nước gia- ven, rẻ. B. Clorua vôi, rẻ. C. Nước gia-ven, mắc. D. Clorua vôi, mắc.
Câu 16: Khi nung nóng, iot rắn biến thành hơi không qua trạng thái lỏng. Hiện tượng này được gọi là:
A. sự ngưng tụ. B. sự bay hơi. C. sự thăng hoa. D. sự phân hủy.
Câu 17: Sản xuất khí clo trong công nghiệp theo phương pháp:
A. Điện phân nóng chảy muối NaCl B. Điện phân dung dịch NaCl có màng ngăn
C. Đốt cháy muối MgCl2 D. Điện phân dung dịch NaCl không
Câu 18: cho 5,6 gam Fe tác dụng với khí Cl2 dư, sau phản ứng thu được m gam muối, giá trị của m là?
A. 61,25 gam B. 15,25 gam C. 16,25 gam D. 16,35 gam
Câu 19: Cho lần lượt dung dịch NaF, NaCl, NaBr, NaI đến dư vào dung dịch AgNO3 . Sau khi phản ứng kết
thúc, có bao nhiêu trường hợp tạo kết tủa?
A. 3 B. 1 C. 2 D. 4
Câu 20: Axit HX là 1 axit yếu, có khả năng ăn mòn thủy tinh, được dùng để khắc chữ, hoa văn lên các vật liệu
bằng thủy tinh. Vậy HX có thể là chất nào sau đây
A. HCl B. HBr C. HI D. HF
Câu 21: Số oxi hóa của Cl trong các chất sau: NaCl, Cl2, KClO3, HClO lần lượt là:
A. +1; 0; +3; +1. B. -1; 0; +5; +1. C. 0; -1; +3; +2. D. -1; 0; +1; +5.
Câu 22: Khí oxi có lẫn ít khí clo để thu được khí oxi tinh khiết người ta dẫn hỗn hợp khí qua dd nào sau đây?
A. NaOH B. NaCl. C. H2SO4 đặc D. NaNO3
Câu 23: Hiện tượng đúng khi nhỏ dd I2/KI vào hồ tinh bột, sau đó đun nóng lên, rồi để nguội là:
A. xuất hiện màu xanh tím, mất màu xanh, màu xanh quay trở lại.
B. xuất hiện màu xanh tím,và màu xanh tím không đổi khi đun nóng hay để nguội.
C. xuất hiện màu đỏ, mất màu đỏ, màu đỏ quay trở lại.
D. xuất hiện màu xanh dương, mất màu xanh, màu xanh quay trở lại.
Câu 24: Tính khối lượng HCl bị oxi hóa bởi MnO2, biết rằng khí Cl2 sinh ra trong phản ứng đó có thể đẩy được
12,7 gam I2 từ dung dịch NaI.
A. 10,3 gam. B. 7,6 gam. C. 7,3 gam. D. 14,6 gam.
II. TỰ LUẬN:( 4 điểm).
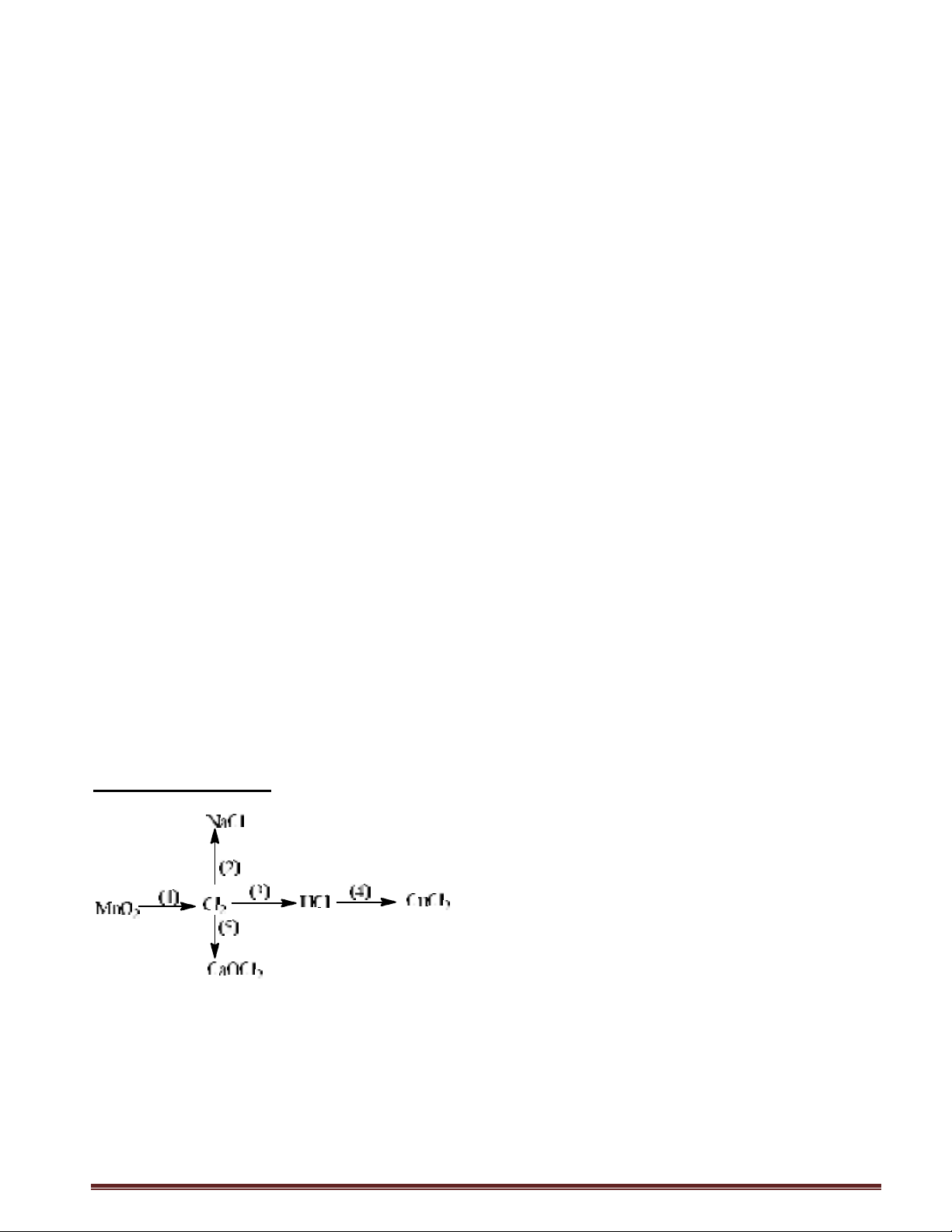
Câu 1: Hoàn thành chuỗi phản ứng sau: (ghi rõ điều kiện của pư nếu có).
Câu 2: Cho 18,6 gam hỗn hợp 2 kim loại Fe, Zn tác dụng với dd HCl loãng dư, sau phản ứng thu được 6,72 lít
khí (đktc).
a) viết các phương trình hóa học xảy ra.
b) Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu.
c) Cũng khối lượng 2 kim loại trên mang đi tác dụng với dd H2SO4 đặc nóng thì thu được V lít khí SO2
(đktc). Giá trị của V là?
Cho biết nguyên tử khối của Fe(56), Zn (65), Al (27), I (127), Cl (35,5), H (1), O (16), S (32),…
*********************** HẾT ************************

GV: PHAN THỊ KIM HẬN Page 3
ĐÁP ÁN ĐỀ KIỂM TRA 1 TIẾT HÓA HỌC 10 – HKII (LẦN 1)
I. TRẮC NGHIỆM: 6 ĐIỂM
Câu 1 2 3 4 5 6 7 8 9 10 11 12
Đáp án C A B C A B A D B A D D
Câu 13 14 15 16 17 18 19 20 21 22 23 24
Đáp án A B B C B C A D B A A C
II. TỰ LUẬN: 4 ĐIỂM.
Câu 1: (1) MnO2 + 4HCl → MnCl2 + 2H2O
(2) Cl2 + 2Na → 2NaCl
(3) Cl2 + H2 → 2HCl
(4) 2HCl + CuO → CuCl2 + H2O
(5) Cl2 + Ca(OH)2 → CaOCl2 + H2O
Câu 2: PTHH:
a) Fe + 2HCl → FeCl2 + H2
a mol………………….a
Zn + 2HCl → ZnCl2 + H2
b mol…………………..b
b). Gọi a, b lần lượt là số mol của Fe, Zn.
Ta có: khối lượng hỗn hợp 2 kim loại là 18,6 gam. 56a+65b = 18,6 (1)
Mặc khác ta có tổng số mol khí H2 là 0,3 mol. Ta có: a + b = 0,3 (2)
Giải hệ phương trình (1) và (2) ta được a= 0,1 mol; b= 0,2 mol.
Vậy % mFe = 0,1*56/(0,1*56 + 0,2*65) =30,1%; vậy %mZn = 69,9%
c). Vì khối lượng kim loại như nhau do đó số mol như nhau.
Nghĩa là số mol Fe = 0,1 mol, số mol Zn = 0,2 mol.
Bản chất khi cho Fe, Zn tác dụng với H2SO4 đặc nóng thì Fe, Cu nhường electron và S (+6) trong H2SO4 đặc
nhận e.
Fe0 -3e → Fe+3
0,1 0,3 mol
Zn0 -2e → Zn+2
0,2 0,4 mol
S+6 + 2e → S+4-
2a a
Áp dụng định luật bảo toàn electron ta có: tổng số mol e nhận = tổng số mol e cho
2a = 0,7 vậy a=0,35 mol vậy V khí SO2 là: 7,84 lít.
GV: PHAN THỊ KIM HẬN Page 4
MA TRẬN ĐỀ KIỂM TRA 1 TIẾT HÓA HỌC 10 – HKII (LẦN 1)
CẤP ĐỘ
TÊN
CHỦ ĐỀ
NHẬN BIẾT THÔNG
HIỂU
VẬN DỤNG
CỘNG
VẬN DỤNG VẬN DỤNG
CAO
1. Khái quát về nhóm
halogen.
Biết được:
- Biết được tên
và kí hiệu các
nguyên tố.
- Biết được
một số quy luật
biến đổi tính
chất của
halogen.
- Vị trí của
halogen trong
BTH
- Hiểu được:
Từ cấu hình e
xác định vị
trí, dự đoán
tính chất hóa
học của
halogen.
- Tính chất
hóa học đặc
trưng của
halogen.
- giải thích
được quy luật
biến đổi của
halogen.
- So sánh
được tính
chất hóa học
của các
halogen.
Số câu
Số điểm
T
ỷ lệ %
Số câu: 2
0,5
8,3
Số câu:1
0,25
4,2
Số câu:0
0
0
Số câu:0
0
0
Số câu:3
0,75
12,5
2. Clo, hidroclorua,
axit clohidric và muối
clorua. Sơ lược hợp
chất có oxi của clo.
Biết được:
- Tính chất vật
lí, trạng thái tự
nhiên, ứng
dụng của clo,
phương pháp
điều chế clo
trong PTN,
trong CN.
- Công thức
hóa học của
hợp chất của
clo và các ứng
dụng quan
trọng của
chúng.
Hiểu được:
- Tính chất
hóa học cơ
bản của clo là
tính oxi hóa
ngoài ra còn
có tính khử.
- Cấu tạo
phân tử của
Cl2, HCl và
tính axit
mạnh của dd
HCl.
- Tính chất
hóa học của
axit HCl.
- Tính oxi
hóa mạnh của
hợp chất có
oxi c
ủa clo.
Vận dụng:
- Phân tích
mô hình thí
nghiệm điều
chế clo trong
PTN.
- Tính khối
lượng muối
cho bài toán
kim loại tác
dụng với clo.
- Cân bằng
phản ứng oxi
hóa khử, điều
chế clo trong
PTN.
Số câu
Số điểm
Tỷ lệ %
Số câu:4
1,0
16,7
Số câu: 3
0,75
12,5
Số câu:2
0,5
8,3
Số câu:0
0
0
Số câu:9
2,25
37,5
3. Flo-Brom-Iot. - Biết được:
- Tính chất vật
lí , trạng thái tự
nhiên, ứng
dụng, điều chế
của flo-brom-
iot.
- Đặc biệt ứng
dụng quan
trọng của axit
Hiểu được:
- Tính oxi
hóa của Flo,
brom, iot. So
sánh được
tính oxi hóa
của các
halogen.
- So sánh tính
axit của các
- Quan sát và
nêu hiện
tượng và giải
thích: thí
nghiệm cho
I2 vào HTB,
đun nóng sau
đó để nguội.
- Viết được
PTHH chứng

GV: PHAN THỊ KIM HẬN Page 5
HF là khắc
thủy tinh.
axit đi từ HF
đến HI.
minh đi từ flo
đến iot tính
oxi hóa giảm
dần.
Số câu
Số điểm
Tỉ lệ%
Số câu: 2
0,5
8,3
Số câu: 1
0,25
4,2
Số câu: 1
0,25
4,2
Số câu: 0
0
0
Số câu: 4
1,0
16.7
4. Luyện tập nhóm
halogen.
- Biết được:
- Hệ thống hóa
lại các nguyên
tố halogen.
- Xác định vị
trí và tính chất
của chúng.
Hiểu được:
- Tính chất
của muối
halogen,
nhận biết các
muối
halogen.
- Tính chất
hóa học của
các halogen,
từ đó xác
định sản
phẩm.
Vận dụng:
- Xác định số
oxi hóa của
halogen trong
dơn chất và
hợp chất.
- Nắm được
tính chất của
chúng để tinh
chế khí.
- Vận dụng kĩ
năng thực
hành để mô
tả và giải
thích mô hình
điều chế clo.
- giait quyết
bài toán điều
chế halogen
và kết hợp
với halogen
mạnh đẩy
halogen yếu
ra khỏi dd
mu
ối.
Số câu
Số điểm
Tỷ lệ %
Số câu: 1
0,25
4,2
Số câu: 3
0,75
12,5
Số câu:2
0,5
8,3
Số câu:2
0,5
8,3
Số câu: 8
2,0
33,3
Tổng số câu
Tổng số điểm
Tỷ lệ %
9
2,25
37,5
8
1,0
33,4
5
1,25
20,8
2
0,5
8,3
24
6
100












![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



