TNU Journal of Science and Technology
230(05): 162 - 170
http://jst.tnu.edu.vn 162 Email: jst@tnu.edu.vn
DEVELOPMENT OF AN HPLC METHOD FOR QUANTIFICATION OF
NUCIFERIN IN LOWLP-PT DRY EXTRACT
Ha Thanh Hoa1, Pham Quoc Tuan1, Ha Quang Loi1, Tran Thi Van Anh1, Dao Viet Hung1, Ngo Thi
Xuan Thinh1, Duong Quoc Toan1, Ha Huong Lan1, Nguyen Thu Quynh2, Nguyen Thi Minh Diep1*
1Phu Tho College of Medicine and Pharmacy, 2TNU - University of Medicine and Pharmacy
ARTICLE INFO
ABSTRACT
Received:
25/11/2024
Nuciferin is an aporphine alkaloid, the main component of Lotus
leaves (Folium Nelumbinis), used as a marker for standardizing
LOWLP-PT dry extract. The extraction and quantification method
using high-performance liquid chromatography (HPLC) for this dry
extract has been developed and validated. The analysis was performed
on an HPLC system using a Phenomenex C18 column (250 × 4.6 mm,
5 µm), with the mobile phase consisting of a mixture of acetonitrile:
water: triethylamine: glacial acetic acid (27.5: 70.1: 1.63: 0.75 v/v),
operated in isocratic mode at a flow rate of 1.2 mL/min, with a sample
injection volume of 10 µl and a detection wavelength of 284 nm using
a PDA detector. The method has been validated and complies with
ICH and AOAC guidelines. Using the developed method, the content
of nuciferin in three lots of the investigated formulation was
determined to be in the range of 0.171 - 0.194% based on the amount
of dried extract.
Revised:
21/01/2025
Published:
22/01/2025
KEYWORDS
Nuciferin
Folium Nelumbinis
HPLC
Dry extract
LOWLP-PT
XÂY DỰNG PHƯƠNG PHÁP ĐỊNH LƯỢNG NUCIFERIN TRONG CAO KHÔ
LOWLP-PT BẰNG HỆ THỐNG SẮC KÝ LỎNG HIỆU NĂNG CAO
Hà Thanh Hòa1, Phạm Quốc Tuấn1, Hà Quang Lợi1, Trần Thị Vân Anh1, Đào Việt Hưng1, Ngô Thị
Xuân Thịnh1, Dương Quốc Toản1, Hà Hương Lan1, Nguyễn Thu Quỳnh2, Nguyễn Thị Minh Diệp1*
1Trường Cao đẳng Y Dược Phú Thọ, 2Trường Đại học Y Dược - ĐH Thái Nguyên
THÔNG TIN BÀI BÁO
TÓM TẮT
Ngày nhận bài:
25/11/2024
Nuciferin là một alkaloid thuốc nhóm aporphin, thành phần chính của
lá Sen, được sử dụng làm chất đánh dấu để tiêu chuẩn hóa cao khô
LOWLP-PT. Phương pháp chiết xuất và định lượng bằng hệ thống
sắc ký lỏng hiệu năng cao (HPLC) trong cao khô đã được xây dựng
và thẩm định. Phân tích thực hiện trên hệ thống HPLC, sử dụng cột
sắc ký Phenomenex C18 (250 × 4,6 mm, 5 µm), pha động là hỗn hợp
acetonitril: nước: triethylamin: acid acetic băng (27,5 : 70,1: 1,63 :
0,75 tt/tt), chạy theo chế độ đẳng dòng với tốc độ 1,2 ml/min, thể tích
tiêm mẫu là 10 µl, bước sóng phát hiện là 284 nm với đầu dò PDA.
Phương pháp được thẩm định và phù hợp với các hương dẫn của ICH
và AOAC. Áp dụng phương pháp đã xây dựng, xác định được hàm
lượng nuciferin của 3 lot chế phẩm nghiên cứu, nằm trong khoảng
0,171 - 0,194% tính theo lượng cao khô kiệt.
Ngày hoàn thiện:
21/01/2025
Ngày đăng:
22/01/2025
TỪ KHÓA
Nuciferin
Lá Sen
Sắc ký lỏng hiệu năng cao
Cao khô
LOWLP-PT
DOI: https://doi.org/10.34238/tnu-jst.11605
* Corresponding author. Email: diepdpt@gmail.com

TNU Journal of Science and Technology
230(05): 162 - 170
http://jst.tnu.edu.vn 163 Email: jst@tnu.edu.vn
1. Giới thiệu
Rối loạn chuyển hóa lipoprotein và tình trạng tăng lipid máu khác (rối loạn lipid máu -
RLLPM) là sự tăng nồng độ các thành phần lipid như cholesterol, triglycerid hoặc cả hai, hoặc
tăng lipoprotein tỷ trọng thấp trong huyết tương, đồng thời giảm HDL - C là thành phần lipid có
lợi, chống xơ vữa động mạch [1]. Y học cổ truyền có các chứng tương ứng với tình trạng
RLLPM như chứng đàm thấp, đầu thống, huyễn vựng,... Nguyên nhân thường do “đàm” ứ đọng ở
kinh lạc, phủ tạng nên RLLPM thường được gọi là chứng Đàm thấp và điều trị chủ yếu bằng
thuốc hóa đàm, trừ thấp [1].
Hiện có nhiều nhóm thuốc hóa dược được sử dụng để điều trị RLLPM có hiệu quả như nhóm
statin, fibrat, resin, acid nicotinic,... tuy nhiên chúng có nhiều tác dụng không mong muốn [2],
[3]. Bên cạnh đó nhiều dược liệu được chứng minh có tác dụng hạ lipid máu như lá Sen, Giảo cổ
lam, Sơn tra, Phan tả diệp, Đan sâm,... [4] – [8] và một số sản phẩm thuốc điều trị hoặc thực
phẩm bảo vệ sức khỏe hỗ trợ điều trị RLLPM từ dược liệu được nghiên cứu về bào chế, đánh giá
tác dụng dược lý, sản xuất lưu hành trên thị trường [4], [9] – [13].
Với mục đích nghiên cứu sản xuất một sản phẩm có nguồn gốc từ thực vật hỗ trợ điều trị
RLLPM, cao khô LOWLP-LP được bào chế thử nghiệm gồm các dược liệu Hà diệp (lá Sen),
Giảo cổ lam, Đan sâm, Táo mèo, Bổ cốt chỉ. Công thức cao khô LOWLP-LP được nghiên cứu
dựa trên công thức Hà đơn phiến (viên nén Hedan) trong Dược điển Trung Quốc (ChP) 2020, giữ
nguyên hàm lượng lá Sen, gia giảm dược liệu, hàm lượng dược liệu cho phù hợp với điều kiện
nguồn cung cấp, trồng trọt tại Việt Nam như thêm dược liệu Giảo cổ lam, thay thế Sơn tra bằng
Táo mèo [4]. Về thành phần hóa học, lá Sen chứa nhiều các nhóm chất như flavonoid, alkaloid,
tinh dầu, phytosterol,... [14], [15]. Trong đó, nuciferin là một alkaloid chính, chiếm ≥ 0,1% tính
theo khối lượng khô và sở hữu nhiều tác dụng sinh học hữu ích [4], [15]. Để góp phần phần xây
dựng tiêu chuẩn cơ sở cao khô và các chế phẩm bào chế chứa lá Sen, chúng tôi tiến hành xây
dựng phương pháp định lượng nuciferin trong cao khô LOWLP-LP bằng phương pháp sắc ký
lỏng hiệu năng cao sử dụng đầu dò PDA.
2. Nguyên liệu, thiết bị và phương pháp nghiên cứu
2.1. Nguyên vật liệu
- Cao khô LOWLP-PT 03 lot (NC012024, NC022024, NC032024) được bào chế từ lá Sen
(Folium Nelumbinis) - thành phần chính, các dược liệu khác: Giảo cổ lam (Herba Gynostemmae),
Đan sâm (Radix et Rhizoma Salviae miltiorrhizae), Táo mèo (Fructus Docyniae), Bổ cốt chỉ chế
muối (Fructus Psoraleae corylifoliae Prereparata) và các tá dược: cellulose vi tinh thể, calci
carbonat, aerosil, natri benzoat,... Lot NC012024 được sử dụng để nghiên cứu xây dựng phương
pháp định lượng.
- Hóa chất, dung môi: Acetonitril (MeCN) dùng cho HPLC, acid acetic băng (CH3COOH)
(hãng Merck, Đức); ethanol 99,7% (EtOH), methanol (MeOH), triethylamin (TEA), chloroform
(CHCl3); amoni hydroxid (25-28) % (NH4OH) (Trung Quốc); nước cất hai lần (H2O).
- Chất chuẩn: nuciferin có độ tinh khiết 98,1% (HPLC), số lô CFS202202, cung cấp bởi hãng
ChemFaces (Trung Quốc).
2.2. Thiết bị
Hệ thống sắc ký lỏng hiệu năng cao (HPLC) CBM-20A detector,
Diode Array SPD-M20A, Shimazu (Nhật Bản); cột sắc ký Phenomenex
C18 (250 × 4,6 mm, 5 µm); cân phân tích AUW220D (Shimadzu, Nhật
Bản); tủ sấy chân không LabTech (Hàn Quốc), thiết bị cô quay chân
không Buchi (Thụy Sĩ), thiết bị chiết hồi lưu (Đức), bể chiết siêu âm D-
78224 (Đức), các dụng cụ thủy tinh, bình định mức, pipet, micropipet có
độ chính xác thích hợp.
Hình 1. Cấu trúc hóa
học của nuciferin

TNU Journal of Science and Technology
230(05): 162 - 170
http://jst.tnu.edu.vn 164 Email: jst@tnu.edu.vn
2.3. Phương pháp nghiên cứu
2.3.1. Khảo sát điều kiện sắc ký
Tham khảo ChP 2020 [4], khảo sát về thành phần và tỷ lệ pha động MeCN : H2O : TEA :
CH3COOH băng, bước sóng phát hiện, thể tích tiêm mẫu, nhiệt độ buồng cột, tốc độ dòng để lựa
chọn điều kiện sắc ký thích hợp.
2.3.2. Khảo sát phương pháp xử lý mẫu
Tham khảo phương pháp chiết chuyên luận viên Hedan trong ChP 2020 [4] có sự điều chỉnh
cho phù hợp, sử dụng dung môi chiết là CHCl3. Cân chính xác khoảng 0,50 g bột mịn cao khô,
thấm ẩm bằng 5 ml NH4OH đặc, chiết hồi lưu với CHCl3 với các thể tích khác nhau (60, 70, 80
và 100 ml), trong khoảng thời gian 2, 3, 4 h. Dịch chiết thu được làm lạnh, lọc sơ bộ, tráng rửa bã
3 lần, mỗi lần 20 ml CHCl3, tách lấy lớp CHCl3 gộp dịch chiết, cô quay chân không đến khi thu
được cắn khô, hòa tan cắn bằng 30 ml MeOH 80% bằng siêu âm trong 2 phút cho tan hoàn toàn.
Bổ sung lượng MeOH 80% hao hụt. Lọc dung dịch thu được qua màng lọc 0,45 µm, định lượng
nuciferin trong điều kiện sắc ký đã xây dựng.
Khảo sát thể tích dung môi chiết, thời gian chiết để được hàm lượng nuciferin tối ưu.
2.3.3. Chuẩn bị các dung dịch chuẩn và thử
Dung dịch chuẩn: Cân và hòa tan nuciferin trong MeOH 80% để được hàm lượng dung dịch
chính xác là 500 mg/ml. Từ dung dịch gốc này, pha thành dãy dung dịch có nồng độ nuciferin
chính xác khoảng 5,0 10, 25, 50, 150,0, 300 g/ml.
Dung dịch thử: Cân chính xác khoảng 5,0 g bột mịn cao khô, chiết theo điều kiện tối ưu ở
mục 2.3.2. được dung dịch thử.
Mẫu trắng: MeOH 80%.
2.3.4. Thẩm định phương pháp
Thẩm định phương pháp phân tích theo hướng dẫn của ICH, AOAC [16], [17].
2.3.5. Tính toán kết quả
Hàm lượng nuciferin trong mẫu cao khô LOWLP-PT tính theo chế phẩm đã sấy khô được tính
theo công thức sau:
X = 𝐶×𝑉
10−2×𝑚×(100−𝐵)
(1)
Trong đó:
- X: Hàm lượng nuciferin trong cao khô (%);
- C: Nồng độ của nuciferin có trong dung dịch mẫu thử được tính từ đường chuẩn tương ứng
(µg/ml);
- V: là thể tích MeOH 80% hòa tan cắn sau khi cô quay (ml);
- m: là khối lượng mẫu thử (g);
- B: là độ ẩm của mẫu thử (%).
2.3.6. Xử lý số liệu thống kê
Mỗi mẫu nghiên cứu được làm lặp lại 3 lần. Kết quả được xử lý thống kê bằng phần mềm
Microsoft Excel 2019.
3. Kết quả nghiên cứu và bàn luận
3.1. Lựa chọn điều kiện sắc ký
3.1.1. Lựa chọn bước sóng phân tích

TNU Journal of Science and Technology
230(05): 162 - 170
http://jst.tnu.edu.vn 165 Email: jst@tnu.edu.vn
Chuẩn bị dung dịch nuciferin chuẩn trong MeOH 80% có nồng độ chính xác khoảng 20
µg/ml. Tiến hành quét phổ UV. Kết quả ghi phổ nuciferin có cực đại hấp thụ tại 232, 270 nm.
Bước sóng 270 được lựa chọn làm bước sóng phát hiện cho phương pháp phân tích [4].
Hình 2. Phổ UV của nuciferin
3.1.2. Kết quả lựa lựa chọn pha động, tốc độ dòng, nhiệt độ cột, thể tích tiêm mẫu
Kết quả khảo sát và lựa chọn được điều kiện sắc ký phân tích nuciferin trong cao khô
LOWLP-PT tối ưu như sau:
- Cột sắc ký phenomenex C18 (250 × 4,6 mm, 5 µm);
- Pha động: MeCN : H2O : TEA : CH3COOH băng (27,5 : 70,1: 1,63 : 0,75 tt/tt), chạy theo
chế độ đẳng dòng;
- Tốc độ dòng: 1,2 ml/min;
- Nhiệt độ cột: 28 - 30 oC;
- Thể tích tiêm mẫu: 10 µl;
- Bước sóng hấp thụ 270 nm.
Ở điều kiện này, trên sắc ký đồ thấy rằng nuciferin tách khỏi các chất trong cao; pic thu được
cân đối, gọn, thời gian lưu (tR) khoảng 16,9 min (Hình 2). Như vậy, điều kiện sắc là phù hợp cho
phương pháp phân tích nuciferin trong cao khô LOWLP-PT.
3.2. Kết quả khảo sát xử lý mẫu
3.2.1. Khảo sát ảnh hưởng của lượng dung môi đối với hiệu suất chiết
Cân chính xác khoảng 0,5 g bột mịn cao khô, xử lý mẫu như mục 2.3.2 với lượng CHCl3 là
60, 70, 80 và 100 ml, thời gian chiết là 3 h. Tiến hành định lượng theo điều kiện sắc ký lựa chọn
ở trên. Kết quả chỉ ra rằng, diện tích pic (Spic) của nuciferin thu được tăng dần khi chiết với
lượng dung môi CHCl3 là 60, 70, 80 ml (p<0,05). Tuy nhiên, khi chiết với lượng CHCl3 là 100 ml
thì Spic không tăng có ý nghĩa thống kê so với chiết với lượng 80 ml (p>0,05). Dó đó, lượng
CHCl3 80 ml được lựa chọn nghiên cứu tiếp.
3.2.2. Khảo sát ảnh hưởng của thời gian chiết đối với hiệu suất chiết
Thực hiện như mục 3.2.1, chiết với lượng dung môi CHCl3 là 80 ml, thời gian chiết là 2, 3, 4
h. Kết quả cho thấy, Spic của nuciferin tăng từ thời gian chiết từ 2 đến 3 h. Tại thời gian chiết 4
h, Spic không khác có ý nghĩa thống kê so với thời gian chiết 3 h (p>0,05). Do vậy, thời gian
chiết được lựa chọn tối ưu là 3 h.
Từ kết quả quá trình khảo sát xử lý mẫu, điều kiện chiết xuất được lựa chọn như sau: Cân
chính xác khoảng 0,50 g bột mịn cao khô, thấm ẩm bằng 5 ml NH4OH đặc, chiết hồi lưu với 80
ml CHCl3 trong 3 h. Dịch chiết thu được làm lạnh, lọc sơ bộ, tráng rửa bã 3 lần, mỗi lần 20 ml
CHCl3, tách lấy lớp CHCl3 gộp dịch chiết, cô quay chân không đến khi thu được cắn khô, hòa tan
cắn bằng 25 ml MeOH 80% bằng siêu âm trong 2 phút cho tan hoàn toàn. Bổ sung lượng MeOH
200.0 225.0 250.0 275.0 300.0 325.0 350.0 375.0 nm
-50
0
50
100
150
200
250
300
350
mAU
16.85/ 1.00
247
373
204
232
270
TNU Journal of Science and Technology
230(05): 162 - 170
http://jst.tnu.edu.vn 166 Email: jst@tnu.edu.vn
80% hao hụt. Lọc dung dịch thu được qua màng lọc 0,45 µm, định lượng nuciferin trong điều
kiện sắc ký đã xây dựng.
3.3. Thẩm định phương pháp định lượng
3.3.1. Tính thích hợp của hệ thống
Tiêm vào hệ thống sắc ký 6 lần, mỗi lần 10 ml dung dịch chuẩn nuciferin trong MeOH 80%
có nồng độ 12,5 µg/ml. Tiến hành sắc ký ở điều kiện đã khảo sát. Kết quả ghi lại ở Bảng 1.
Bảng 1. Kết quả khảo sát tính thích hợp hệ thống
Số lần phân tích
tR (min)
Spic (mAU.s)
1
16,977
274445
2
16,935
274444
3
16,923
274714
4
16,945
274917
5
16,929
273986
6
16,930
274424
M ± SD
16,930 ± 0,019
274497 ± 351
RSD (%)
0,11
0,13
Từ kết quả ở Bảng 1 cho thấy độ lệch chuẩn tương đối (RSD) của tR và Spic nuciferin < 2%.
Như vậy, hệ thống phù hợp cho việc xác định hàm lượng nuciferin trong mẫu cao khô bằng
phương pháp đã xây dựng.
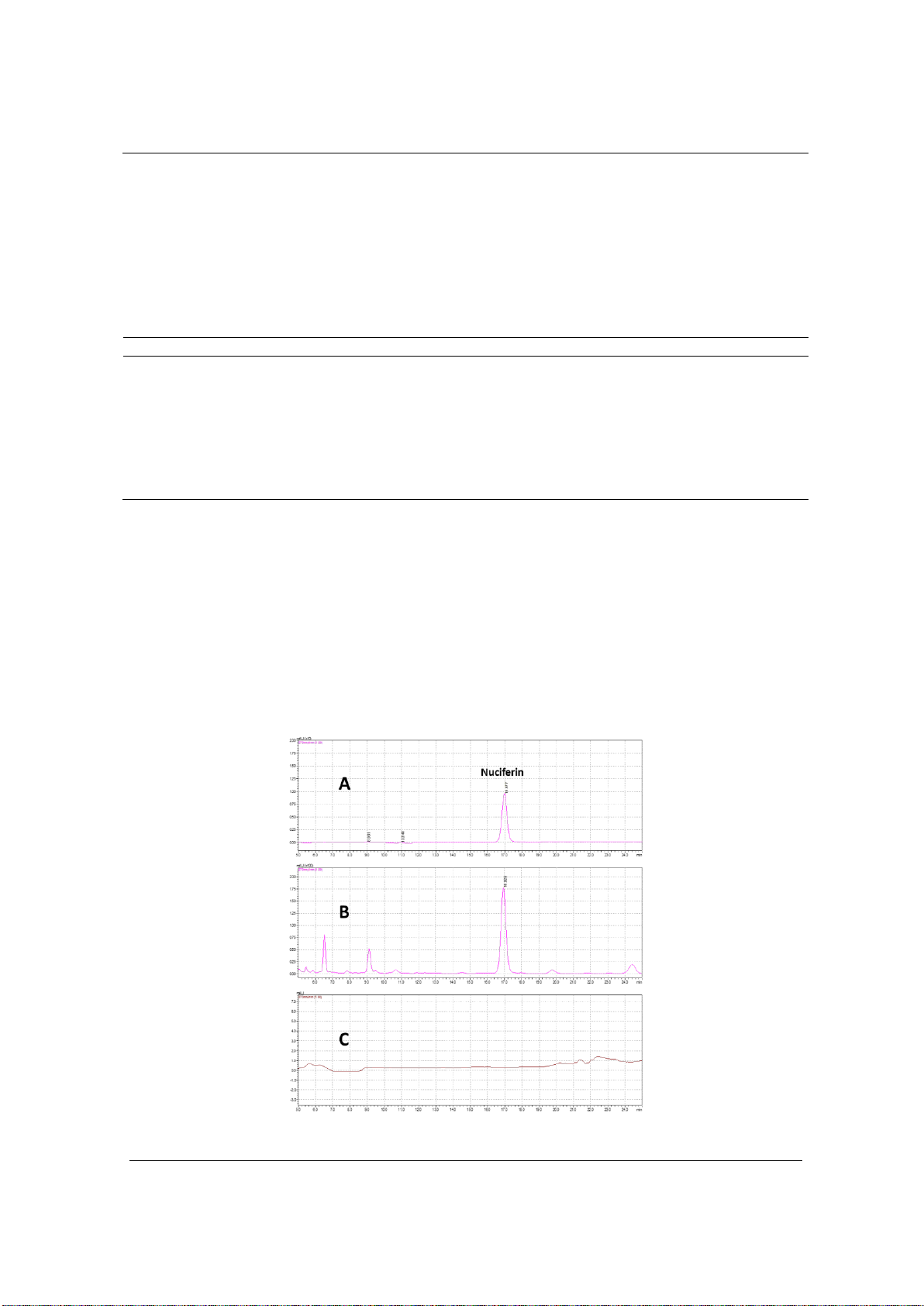
3.3.2. Độ đặc hiệu
Tiến hành sắc ký trong cùng điều kiện các mẫu thử, mẫu chuẩn nuciferin (nồng độ 15,0
µg/ml), và mẫu trắng (MeOH 80%). Kết quả cho thấy, trên sắc ký đồ của mẫu trắng không có pic
tạp tại thời gian lưu của pic chuẩn nuciferin; pic của nuciferin trên sắc ký đồ mẫu chuẩn và mẫu
thử có hình dạng phổ UV của các pic tương đồng và cùng thời gian lưu (p>0,05) (Hình 3). Mặt
khác, độ tinh khiết của pic nuciferin trên dung dịch chuẩn, dung dịch thử gần bằng 1 (0,99999),
số đĩa lý thuyết bằng 3.328 > 2.000 [4]. Như vậy, phương pháp đã xây dựng đáp ứng được yêu
cầu về độ đặc hiệu.
Hình 3. Sắc ký đồ HPLC của các dung dịch: chuẩn (A); thử (B); mẫu trắng (C)


![Câu hỏi ôn tập Thực tập sản xuất thuốc 1 [năm]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250708/kimphuong1001/135x160/8021751942094.jpg)





![Bài giảng Loãng xương ThS. Đoàn Công Minh [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250516/phongtrongkim0906/135x160/2181747392752.jpg)



![Bài giảng Vi sinh vật: Đại cương về miễn dịch và ứng dụng [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251124/royalnguyen223@gmail.com/135x160/49791764038504.jpg)