
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC SƯ PHẠM TP. HỒ CHÍ MINH
KHOA HÓA HỌC
KHẢO SÁT THÀNH PHẦN HÓA HỌC VÀ HOẠT TÍNH
ỨC CHẾ ENZYM α-GLUCOSIDASE CỦA CAO HEXAN
LÁ BÌNH BÁT DÂY COCCINIA GRANDIS (L.) J. VOIGT
HỌ BẦU BÍ (CUCURBITACEAE)
KHÓA LUẬN TỐT NGHIỆP
CỬ NHÂN HÓA HỌC
Chuyên ngành: Hóa hữu cơ
Hướng dẫn khoa học: TS. LÊ TIẾN DŨNG
Sinh viên thực hiện: TRẦN THỊ KIM HỒNG
Tp HCM - 5/2013

i
LỜI CẢM ƠN
Với tấm lòng kính trọng và biết ơn sâu sắc,em xin chân thành gửi lời cảm ơn đến:
• TS. Lê tiến Dũng – phòng hợp chất thiên nhiên có hoạt tính sinh học, thầy
đãtận tình hướng dẫn, giúp đỡ, cung cấp kiến thức, dộng viên, tạo mọi diều
kiện giúp em hoàn thành đề tài khóa luận tốt nghiệp này.
• TS. Mai Đình Trị - phòng hợp chất thiên nhiên có hoạt tính sinh học, thầy đã
giúp đỡ, cho em những ý kiến quý báu để em hoàn thiện đề tài của mình
• Thầy cô bộ môn hóa hữu cơ – Khoa hóa – Trường đại học Sư Phạm tp HCM
và các thầy cô của viện khoa học và công nghệ Việt Nam đã tạo mọi điều
kiện giúp đỡ em hoàn thành khóa luận tốt nghiệp.
• Anh Nguyễn Hữu An-khóa k33, ĐH Sư phạm đã hướng dẫn, giúp đỡ em
hoàn thành khóa luận này.
• Các bạn làm cùng phòng 19 – Viện khoa học và công nghệ Việt Nam, các
bạn lớp hóa 4C đã động viên và giúp đỡ tôi trong quá trình thực hiện đề tài.
• Con xin cảm ơn ba mẹ đã quan tâm, động viên và hỗ trợ con về mọi mặt
trong suốt quá trình học tập, thực hiện đề tài tốt nghiệp này.
Thành phố Hồ Chí Minh, tháng 5 năm 2013
Sinh viên: Trần Thị Kim Hồng

ii
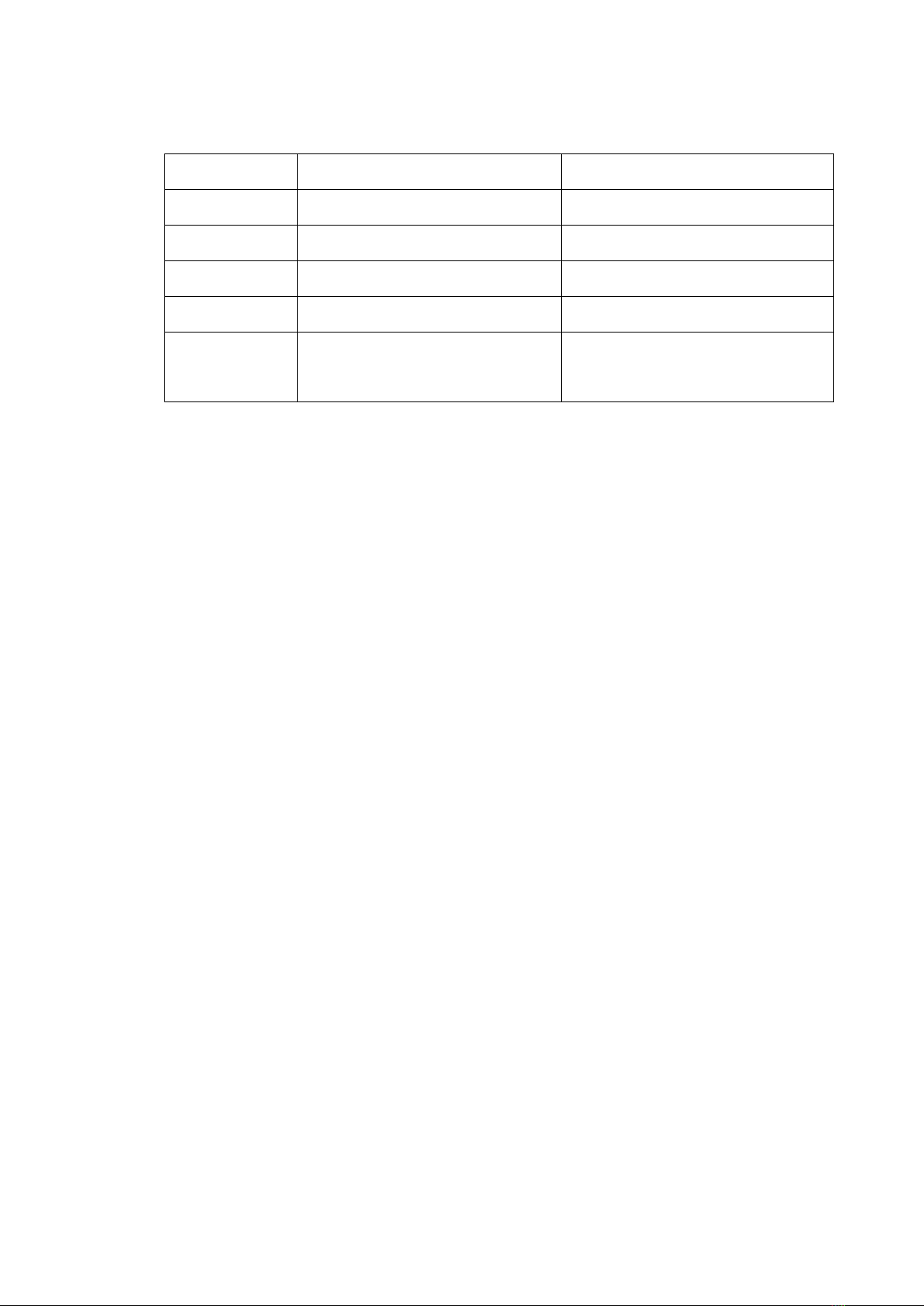
DANH MỤC CÁC TỪ VIẾT TẮT
Kí hiệu
Tiếng anh
Tiếng việt
H
Hexane
C
Chloroform
EA
Ethyl acetate
EtOH
Ethanol
M
Methanol
SKLM
Sắc kí lớp mỏng
SKC
Sắc kí cột
NMR
Nuclear Magnetic
Resonance Phổ cộng hưởng từ hạt nhân
13C-NMR
Carbon (13) nuclear
magnetic resonance
Phổ cộng hưởng từ hạt nhân
carbon (13)
1H-NMR
Hydro (1) nuclear
magnetic resonance
Phổ cộng hưởng từ hạt nhân
proton (1)
HMBC
Heteronuclear Multiple
bond Coherence
Phổ tương tác dị hạt nhân qua
nhiều liên kết
HSQC
Heteronuclear Single
Quantum Coherence
Phổ tương tác dị hạt nhân qua
một liên kết
δ
Chemical shift
Độ dịch chuyển hóa học
ppm
Part per million
Phần triệu
Mp
Melting point
Điểm nóng chảy
s
Singlet
Mũi đơn
d
Doublet
Mũi đôi
dd
Doublet of doublet
Mũi đôi đôi
iii
J
Coupling constant
Hằng số ghép spin
(M)Hz
(Mega) Hertz
g
Gram
mg
Milligram
Kg
Kilogram
IC50
half maximal inhibitory
concentration 50% nồng độ ức chế tối đa

iv
DANH MỤC CÁC BẢNG
Bảng 2.1. Kết quả sắc ký cột cao BBD2(13,7g) ............................................. 23
Bảng 2.2. Kết quả sắc khí cột silica gel cao BBD2.10 (567,4mg). ................ 23
Bảng 3.1 Kết quả IC50 của các mẫu cao Bình bát dây .................................... 26
DANH MỤC CÁC SƠ ĐỒ
Sơ đồ 2.1 Điều chế mẫu thử hoạt tính ......................................................... 17
Sơ đồ 2.2 Phản ứng thủy phân enzym α-glucosidase với cơ chất là p-
Nitrophenyl-α-D-glucopyranoside ............................................................... 18
Sơ đồ 2.3 Điều chế cao thô ............................................................................ 21
Sơ đồ 2.4 Quy trình điều chế các phân đoạn từ cao n-hexan .................... 22

![Tiểu luận Cơ sở Hóa sinh: Bài luận [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250710/hoangmaiphuong_t66@hus.edu.vn/135x160/622_bai-tieu-luan-co-so-hoa-sinh.jpg)



















![Ô nhiễm môi trường không khí: Bài tiểu luận [Nổi bật/Chi tiết/Phân tích]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251011/kimphuong1001/135x160/76241760173495.jpg)




