
GVHD:
Huỳnh Th H ng Hoaị ồ
SVTH:
Kim Ng c Ph ng Bìnhọ ươ
Nguy n Văn Tâmễ
Trình Qu c Thanhố
L u Thanh Ti nư ề
Nguy n Qu c Vinhễ ố
Fe

N I DUNGỘ
I. Đ C ĐI M NHÓM VIIIB Ặ Ể
II. C U T O Ấ Ạ
III. TÍNH CH T V T LÝẤ Ậ
IV. TÍNH CH T HÓA H CẤ Ọ
V. Đi u CH - NG D NGề Ế Ứ Ụ
TÀI LI U THAM KH OỆ Ả
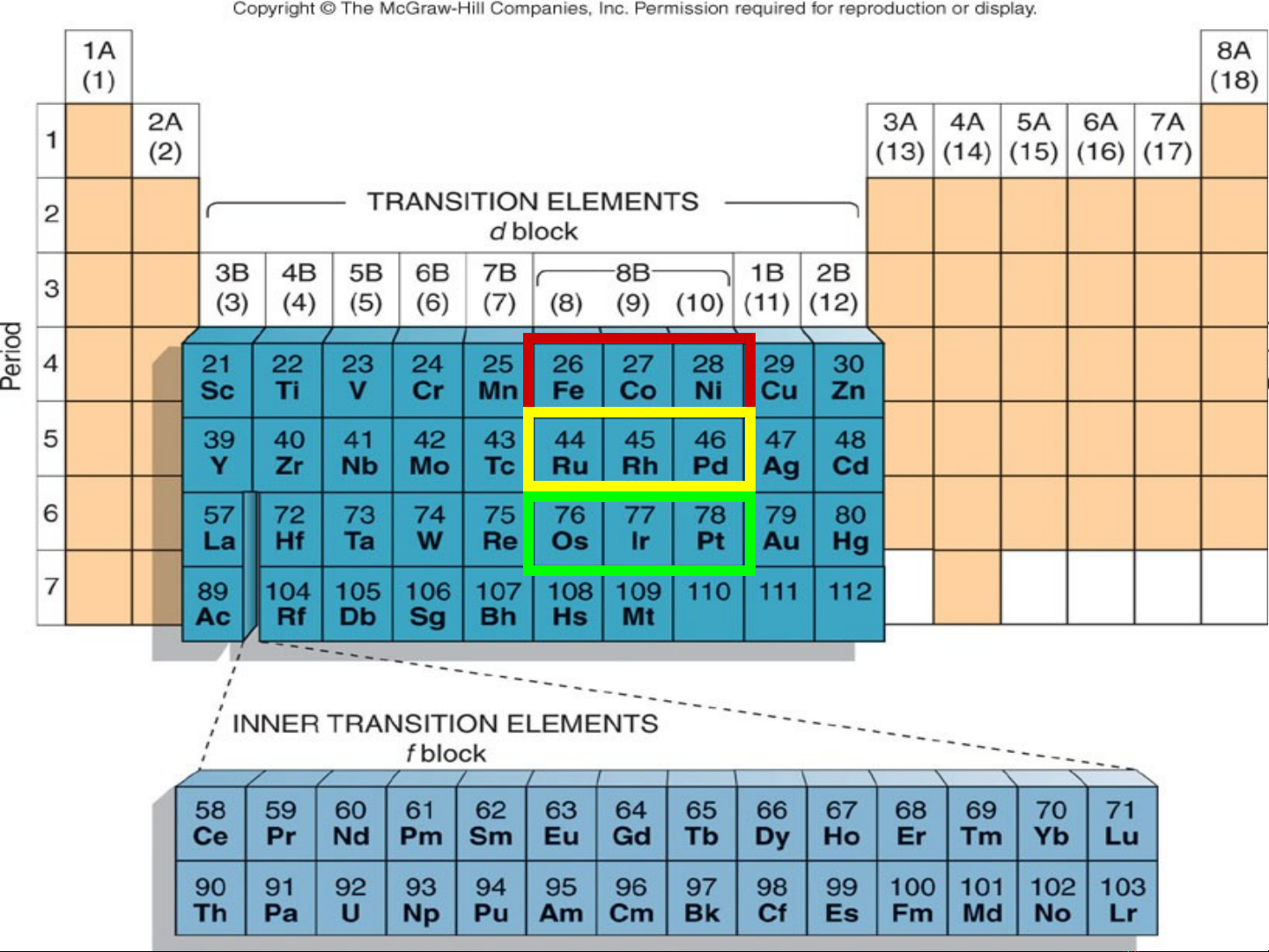
NHÓM VIIIB

Nhóm VIIIB c a b ng tu n hoàn g m 3 c t d c, hình ủ ả ầ ồ ộ ọ
thành 3 h nguyên t theo chi u ngang.ọ ố ề
ØH S t: Fe, Co, Ni.ọ ắ
ØH Platin nh : Ru, Rh, Pd.ọ ẹ
ØH Platin n ng: Os, Ir, Pt.ọ ặ
I. Đ C ĐI M C A NHÓM VIIIBẶ Ể Ủ














![Ô nhiễm môi trường không khí: Bài tiểu luận [Nổi bật/Chi tiết/Phân tích]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251011/kimphuong1001/135x160/76241760173495.jpg)







![Ứng dụng kỹ thuật trao đổi ion trong điện phân: Bài tiểu luận [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250829/sonphamxuan1808/135x160/97341756442892.jpg)



