Tác giả: Nguyễn Đình Hành
TOÁN V Đ TAN VÀ TINH TH HYĐRATỀ Ộ Ể
I- KI N TH C C B NẾ Ứ Ơ Ả :
1)Công th c ứtoán:
ct
H O
2
m
S 100
m
= ⋅
( gam/ 100g H
2
O)
C%
S 100
100 C%
= ⋅
−
( C% là n ng đ % c a dung d ch bão hòa)ồ ộ ủ ị
S
C% 100%
100 S
= ⋅
+ ( C% là n ng đ % c a dung d ch bão hòa)ồ ộ ủ ị
2) Bài toán xác đ nh l ng k t tinhị ượ ế .
* Khi làm l nh m t dung d ch bão hòa ch t tan r n thì đ tan th ng gi m xu ng, vì v y có ạ ộ ị ấ ắ ộ ườ ả ố ậ
m t ph n ch t r n không tan b tách ra ( g i là ph n k t tinh):ộ ầ ấ ắ ị ọ ầ ế
+ N u ch t k t tinh khôế ấ ế ng ng m n c thì l ng n c trong hai dung d ch bão hòa b ng nhau.ậ ướ ươ ướ ị ằ
+ N u ch t r n k t tinh có ng m n c thì l ng n c trong dung d ch sau ít h n trong dung ế ấ ắ ế ậ ướ ượ ướ ị ơ
d ch ban đ u:ị ầ
H O
H O
22
m ( sau) m (
H O
2
dd dd bñ) - m (KT) =
* Các b c gi i toán:ướ ả
TH
1
: ch t k t tinh không ng m nấ ế ậ ư cớ TH
2
: ch t k t tinh ng m n cấ ế ậ ướ
B
1
: Xác đ nh ị
ct
m
và
H O
2
m
có trong ddbh tở
0
cao.
B
2
: Xác đ nh ị
ct
m
có trong ddbh tở
0
th p ( l ng ấ ượ
n c không đ i)ướ ổ
ct H O
2
S
m m
100
= ⋅
B
3
: Xác đ nh l ng ch t k t tinh:ị ượ ấ ế
ct ct
KT
m m (nh ) m ( )ieät ñoä cao nhieät ñoä thaáp= −
B
1
: Xác đ nh ị
ct
m
và
H O
2
m
có trong ddbh tở
0
cao.
B
2
: Đ t s mol c a hiđrat b k t tinh là a (mol)ặ ố ủ ị ế
⇒
ct
m (KT)
H O
2
vaø m (KT)
B
3
: L p ph ng trình biậ ươ ểu di n đ tan c a dung ễ ộ ủ
d ch sau ( theo n a)ị ẩ
ct
2
H O
2
m
S 100
m
∆
= ⋅
∆
B
4
: Gi i ph ng trình và k t lu n.ả ươ ế ậ
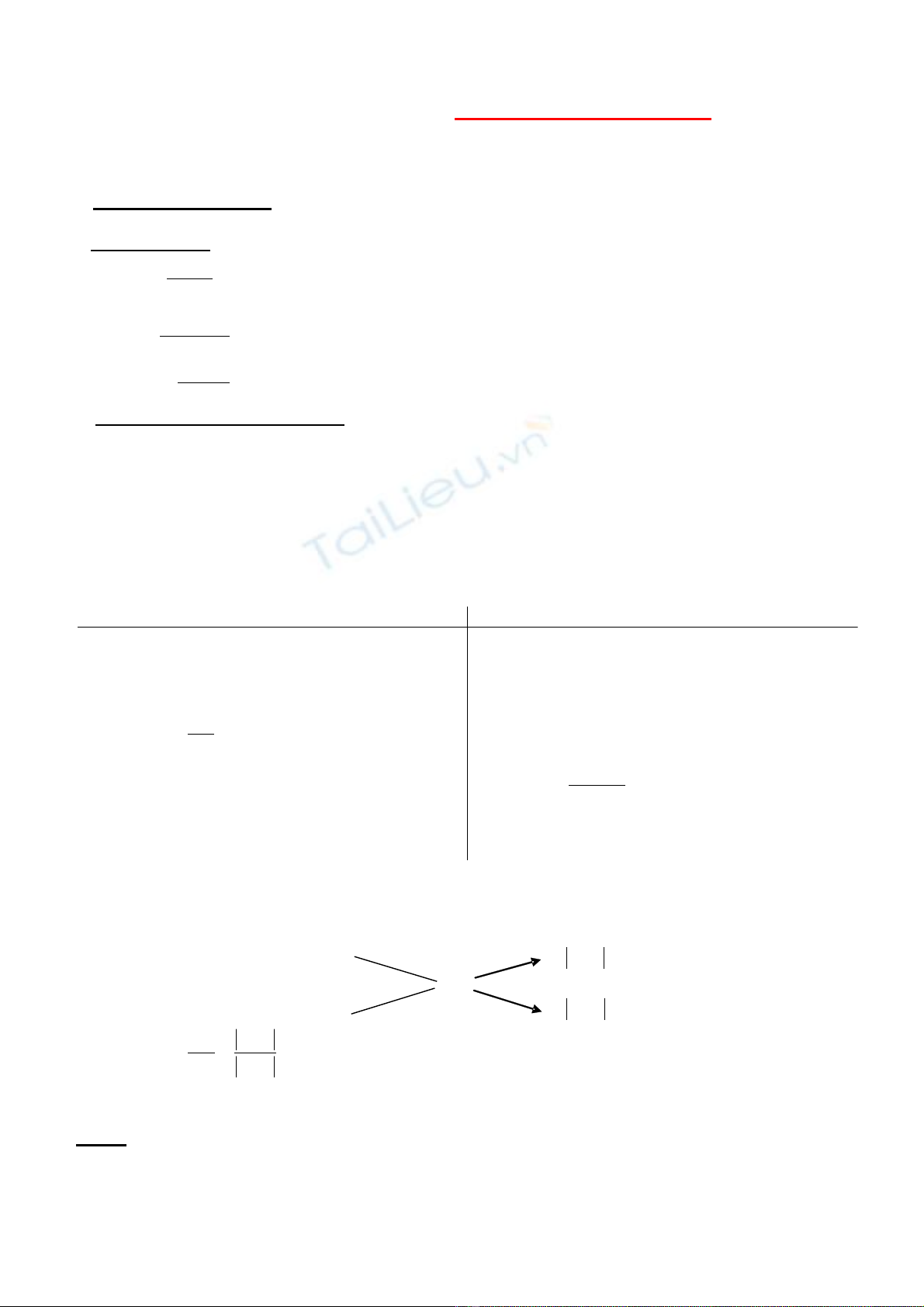
* Ph ng pháp gi i thông minh:ươ ả
Có thể gi i đ c các bài toán xác đ nh d ng k t tinh b ng ph ng pháp đ ng chéo. Mu n ả ượ ị ượ ế ằ ươ ườ ố
làm đ c đi u này chúng tượ ề a ph i đ t gi thi t ng cả ặ ả ế ượ .
R n (KT)ắ m
1
C% = x
z y−
z %
ddbh sau m
2
C% = y
x z−
Suy ra ta có : mz y
1
m x z
2
−
=−
N u bi t kh i l ng dung d ch ban đ uế ế ố ượ ị ầ thì ta hoàn toàn tính đ c ượ kh i l ng ch t r n k t tinh ố ượ ấ ắ ế
( dù ch t này có ng m n c hay không ng m n c)ấ ậ ướ ậ ướ
Chú ý:
1

Tác gi :ả Nguy n Đình Hànhễ
II- BÀI T P ÁP D NG:Ậ Ụ
1) Làm l nh 600g ddbh NaCl t 90ạ ừ
0
C → 10
0
C thì có bao nhiêu gam tinh th NaCl tách ra. Bi t ể ế
đ tan c a NaCl 90ộ ủ ở
0
C và 10
0
C l n l t là : 50gam ; 35 gamầ ượ .
H ng d n ướ ẫ :
* 90Ở
0
C có T = 50 gam nên ta có : 100gam H
2
O + 50g NaCl
→
150g ddbh
? ? 600g
⇒
NaCl
600 50
m (tan) 200g
150
⋅
= =
⇒
2
H O
m ( ) 600 200 400gdung moâi = − =
( không
đ i)ổ
* 10Ở
0
C có T = 35 g nên ta có : 100 gam H
2
O hoà tan đ c 35 g NaClượ
400g
→
?
⇒
NaCl
400 35
m (tan) 140g
100
⋅
= =
Kh i l ng NaCl k t tinh :ố ượ ế 200 – 140 = 60 gam
2) Đ tan c a CuSOộ ủ
4
85ở
0
C và 12
0
C l n l t là 87,7g và 35,5g . Khi làm l nh 1887 gam dung ầ ượ ạ
d ch bão hoà CuSOị
4
t 80ừ
0
C
→
12
0
C thì có bao nhiêu gam tinh th CuSOể
4
.5H
2
O tách ra kh iỏ
dung d ch.ị
H ng d n :ướ ẫ L u ý vì ch t k t tinh ng m n c nên l ng n c trong dung d ch thay đ iư ấ ế ậ ướ ượ ướ ị ổ
85Ở
0
C ,
4
CuSO
T=
87,7 gam ⇒ 187,7 gam ddbh có 87,7 gam CuSO
4
+ 100g H
2
O
1887g ---------------
→
887gam CuSO
4
+ 1000g H
2
O
G i x ọlà s mol CuSOố
4
.5H
2
O tách ra
⇒ kh i l ng Hố ượ
2
O tách ra : 90x (g)
Kh i l ng CuSOố ượ
4
tách ra : 160x( gam)
12Ở
0
C,
4
CuSO
T=35,5 nên ta có ph ng trình : ươ
887 160x 35,5
1000 90x 100
−=
−
gi i ra x = 4,08 ả
mol
Kh i l ng CuSOố ượ
4
.5H
2
O k t tinh : 250ế × 4,08 =1020 gam
3) Cho 0,2 mol CuO tan hoàn toàn trong H
2
SO
4
20% đun nóng, sau đó làm ngu i dung d ch ộ ị
đ n 10ế
0
C. Tính kh i l ng tinh th CuSOố ượ ể
4
. 5H
2
O đã tách ra kh i dung d ch, bi t r ng đ tan ỏ ị ế ằ ộ
c a CuSOủ
4
10ở
0
C là 14,4 gam/100g H
2
O. ( ĐS: 30,7 gam )
H ng d n :ướ ẫ
CuO + H
2
SO
4
→
CuSO
4
+ H
2
O
0,2 0,2 0,2 0,2 ( mol)
Kh i l ng ddHố ượ
2
SO
4
: 0, 2 98 100%
20
⋅ ⋅ = 98g
Kh i l ng CuSOố ượ
4
t o ra : 0,2ạ× 160 = 32 gam
G i x là s mol CuSOọ ố
4
.5H
2
O tách ra ⇒ m
dd (sau p )ư
= (0,2× 80) + 98 – 250x ( gam)
Vì đ tan c a CuSOộ ủ
4
10ở
0
C là T = 14,4 gam , nên ta có :
32 160x 14, 4
112 250x 114, 4
−=
− gi i ra x = 0,1228 mol ả⇒
CuSO .5H O
4 2
m (KT) 30,7=gam
4) Có 600 gam dung d ch KClOị
3
bão hoà ( 20
0
C) n ng đ 6,5% cho bay b t h i n c sau đó ồ ộ ớ ơ ướ
l i gại h n h p 20ữ ỗ ợ ở
0
C ta đ c m t h n h p có kh i l ng chung là 413gam. ượ ộ ỗ ợ ố ượ
a) Tính kh i l ng ch t r n k t tinhố ượ ấ ắ ế
b) Tính kh i l ng n c và kh i l ng KClOố ượ ướ ố ượ
3
trong dung d ch còn l i.ị ạ
H ng d nướ ẫ : làm bay h i b t n c m t dung d ch bão hoà và đ a v nhi t đ ban ơ ớ ướ ộ ị ư ề ệ ộ đ u thì ầ
luôn có xu t hi n ch t r n k t tinhấ ệ ấ ắ ế
Đ t kh i l ng r n KT là : x(g) , g i l ng dung d ch sau khi bay h i là : y(g)ặ ố ượ ắ ọ ượ ị ơ
2

Tác gi : ảNguyễn Đình Hành
Bài t p t ng tậ ươ ự:
5) Có 540 g ddbh AgNO
3
10ở
0
C, đun nóng dd đ n 60ế
0
C thì ph i thêm bao nhiêu gam AgNOả
3
đ đểt b o ạ ả
hoà. Bi t đ tan AgNOế ộ
3
10ở
0
C và 60
0
C l n l t là 170g và 525gam.ầ ượ
6 Xác đ nh l ng k t tinh MgSOị ượ ế
4
.6H
2
O khi làm l nh 1642g ddbh t 80ạ ừ
0
C xu ng 20ố
0
C. Bi t đ tan c a ế ộ ủ
MgSO
4
là 64,2 g ( 80
0
C) và 44,5g (20
0
C).
7) Cho bi t n ng đ dd ế ồ ộ bão hòa KAl(SO
4
)
2
2ở0
0
C là 5,56%
a) Tính đ tan c a KAl(SOộ ủ
4
)
2
20ở
0
C
b) L y m gam dung d ch bão hoà KAl(SOấ ị
4
)
2
.12H
2
O 20ở
0
C đ đun nóng bay h i 200g n c, ph n còn ể ơ ướ ầ
l i làm l nh đ n 20ạ ạ ế
0
C . Tính kh i l ng tinh th phèn KAl(SOố ượ ể
4
)
2
.12H
2
O k t tinh.ế
8) Cho bi t đ tan c a CaSOế ộ ủ
4
là 0,2 gam/100g n c nhi t đ 20ướ ở ệ ộ
0
C và kh i l ng riêng c a dung d ch ố ượ ủ ị
bão hoà CaSO
4
20ở
0
C là D =1g/ml. N u tr n 50ml dung d ch CaClế ộ ị
2
0,012M v i 150ml dung d ch ớ ị
Na
2
SO
4
0,04M ( 20ở
0
C) thì có k t t a xu t hi n hay không ?ế ủ ấ ệ
H ng d n :ướ ẫ tính n ng đ c a CaSOồ ộ ủ
4
trong dung d ch thu đ c, n u bé h n n ng đ bão hoà thì không ị ượ ế ơ ồ ộ
có k t t a ( và ng c l i)ế ủ ượ ạ . K t qu : không có k t t a.ế ả ế ủ
9) 12Ở
0
C có 1335gam dung d ch bão hoà CuSOị
4
. Đun nóng dung d ch lên đ n 90ị ế
0
C. H i ph i thêm vào ỏ ả
dung d ch bao nhiêu gam CuSOị
4
n a đ đữ ể c dung d ch bão hoà nhi t đ này.ượ ị ở ệ ộ
Bi t đ tan CuSOế ộ
4
12ở
0
C và 90
0
C l n l t là 33,5g và 80gầ ượ
(ĐS: 465gam CuSO
4
)
10) Thêm d n dung d ch KOH 33,6% vào 40,3ml dung d ch HNOẫ ị ị
3
37,8% ( D = 1,24 g/ml) đ n khi trung ế
hoà hoàn toàn thì thu đ c dung d ch A. Đ a ượ ị ư dung d ch A v 0ị ề
0
C thì đ c dung d ch B có n ng đ 11,6% ượ ị ồ ộ
và kh i l ng mu i tách ra là m (gam). ố ượ ố Hãy tính m và cho bi t dung d ch B đã bão hoà ch a ? vì sao ?ế ị ư
ĐS: m = 21,15 gam , dung d ch đã bão hoà vì có m ( gam ) mu i không tan thêm đ c n aị ố ượ ữ
----------------------------------
Tài li u này vi t d ng file nh ch đ c không ch nh s a đ cệ ế ạ ả ỉ ọ ỉ ử ượ !
3


























