
TNU Journal of Science and Technology
230(01): 474 - 482
http://jst.tnu.edu.vn 474 Email: jst@tnu.edu.vn
OPTIMIZING FERMENTATION CONDITIONS FOR PURPLE ONION
(ALLIUM CEPA L.) USING BACILLUS SUBTILIS BSN5 TO PRODUCE PRODUCTS
RICH IN CARBOXYMETHYL CELLULASE FOR POULTRY FARMING
Phan Vu Hai1, Nguyen Dinh Thuy Khuong1*, Tran Ngoc Liem1, Ngo Huu Lai2, Nguyen Xuan Hoa1
1College of Agriculture and Forestry - Hue University, 2Regional Animal Health Office No.4
ARTICLE INFO
ABSTRACT
Received:
09/9/2024
This study focused on optimizing the fermentation process of purple
onion using the bacterial strain Bacillus subtilis BSn5 to produce the
CMCase enzyme, thereby creating biological products to replace
antibiotics in poultry farming. Factors affecting the fermentation
process such as nitrogen source, raw material:water ratio,
carbon:nitrogen ratio, initial pH, fermentation temperature and time,
and glucose supplementation were evaluated. The results showed that
ammonium sulfate was the best nitrogen source and the optimal
carbon:nitrogen ratio was 20:1. The optimal initial pH, raw
material:water ratio and fermentation temperature were 4.0, 1:3 and
35°C, respectively. The ideal fermentation time was 144 h and adding
1 g/100 g glucose enhanced the enzyme production. Response surface
analysis determined the final optimum conditions to be a
carbon:nitrogen ratio of 25:1, initial pH of 3.2 and feedstock:water
ratio of 1:3.25. Under these conditions, high CMCase enzyme activity
(58.98 U/g) was achieved, demonstrating this process's potential for
producing high-value feed additives from purple onion.
Revised:
17/12/2024
Published:
18/12/2024
KEYWORDS/
Allium cepa L.
Bacillus subtilis
Fermentation
CMCase
Cellulose
TỐI ƯU HÓA ĐIỀU KIỆN LÊN MEN HÀNH TÍM (ALLIUM CEPA L.) BẰNG
BACILLUS SUBTILIS BSN5 NHẰM SN XUT CH PHM GIU
CARBOXYMETHYL CELLULASE TRONG CHĂN NUÔI GIA CM
Phan V Hi1, Nguyễn Đinh Thuỳ Khương1*, Trần Ngọc Liêm1, Ngô Hu Lai2, Nguyễn Xuân Ha1
1Trưng Đi hc Nông Lâm - ĐH Hu, 2Chi cc Th y Vng 4
THÔNG TIN BÀI BÁO
TÓM TẮT
Ngày nhận bài:
09/9/2024
Nghiên cứu này tập trung vào việc tối ưu hóa quy trình lên men hành
tím bằng chủng vi khuẩn Bacillus subtilis BSn5 để sản xuất enzyme
CMCase, từ đó tạo ra ch phẩm sinh hc thay th khng sinh trong
chăn nuôi gia cm. Các yu tố ảnh hưởng đn qu trình lên men như
nguồn nitrogen, tỷ lệ nguyên liệu:nước, tỷ lệ carbon:nitrogen, pH ban
đu, nhiệt độ và thời gian lên men, cũng như việc bổ sung glucose đã
được đnh gi. Kt quả cho thấy ammonium sunfate là nguồn nitrogen
tốt nhất và tỷ lệ carbon:nitrogen tối ưu là 20:1. Gi trị pH ban đu, tỷ
lệ nguyên liệu:nước và nhiệt độ lên men tối ưu ln lượt là 4,0, 1:3 và
35°C. Thời gian lên men lý tưởng là 144 giờ và việc bổ sung 1 g/100
g glucose tăng cường cho quá trình sản xuất enzyme. Phân tích bề mặt
đp ứng đã xc định được cc điều kiện tối ưu cuối cùng là tỷ lệ
carbon:nitrogen 25:1, pH ban đu 3,2 và tỷ lệ nguyên liệu:nước 1:3,25.
Trong điều kiện này, hoạt độ enzyme CMCase đạt mức cao (58,98
U/g), chứng tỏ tiềm năng của quy trình này trong việc sản xuất phụ
gia thức ăn chăn nuôi gi trị cao từ hành tím.
Ngày hoàn thiện:
17/12/2024
Ngày đăng:
18/12/2024
TỪ KHÓA
Hành tím
Bacillus subtilis
Lên men
Enzyme CMCase
Cellulose
DOI: https://doi.org/10.34238/tnu-jst.11084
* Corresponding author. Email: nguyendinhthuykhuong@huaf.edu.vn

TNU Journal of Science and Technology
230(01): 474 - 482
http://jst.tnu.edu.vn 475 Email: jst@tnu.edu.vn
1. Giới thiệu
Nhu cu ngày càng tăng đối với thịt và trứng gia cm đã gây p lực đng kể lên ngành chăn
nuôi gia cm để nâng cao hiệu quả sản xuất. Khng sinh đã được sử dụng rộng rãi như một chất
kích thích tăng trưởng và cũng để tăng cường khả năng miễn dịch của gia cm chống lại các bệnh
truyền nhiễm [1]. Tuy nhiên, việc sử dụng rộng rãi khng sinh trong hơn 50 năm đã dẫn đn sự
xuất hiện của vi khuẩn kháng thuốc và dư lượng thuốc trong các sản phẩm gà thịt [2], [3]. Sự xuất
hiện ngày càng nhiều của các mm bệnh kháng kháng sinh không chỉ làm phức tạp qu trình điều
trị nhiễm khuẩn ở gia cm mà còn gây ra mối đe da lớn đối với sức khỏe cộng đồng [4]. Do đó,
việc phát triển các lựa chn thay th an toàn và đng tin cậy cho khng sinh thúc đẩy tăng trưởng
đã trở thành một mục tiêu cn thit.
Thảo dược và chit xuất từ chúng mang lại nhiều lợi ích sức khỏe, với chức năng khng khuẩn,
điều hòa miễn dịch và thúc đẩy tăng trưởng [5]. Hành tím, thuộc chi Allium cùng với tỏi và hành
tây, là nguồn giàu polyphenol, flavonoid và sulfide [6], [7]. Hành tím cũng cung cấp lượng vitamin
A, C, khoáng chất và chất xơ dồi dào [8]. Loại cây này được sử dụng trong thực phẩm và dược liệu
nhờ tác dụng chống oxy hóa, giải độc và chống ung thư, đặc biệt nhờ vào polyphenol và vitamin
chống oxy hóa [9], [10]. Các hợp chất chứa lưu huỳnh trong hành tím cũng đã được chứng minh
có khả năng khng khuẩn [11]. Tuy nhiên, cây hành, đặc biệt là ở phn thân và lá, có hàm lượng
cellulose cao, chim khoảng 41-50% thành phn vật chất khô [12]. Một số động vật nhai lại có thể
sử dụng một lượng lớn thức ăn thô chất lượng thấp làm nguồn năng lượng do vi sinh vật phân hủy
chất xơ trong đường tiêu hóa [13]. Tuy nhiên, hu ht cc loài động vật khác, trong đó có gia cm
ít có khả năng sử dụng cellulose này [14]. Động vật không thể sử dụng hoàn toàn xơ thức ăn và
20–70% cellulose được thải ra ngoài theo phân [15]. Do đó, có thể kt hợp các thuộc tính probiotic
của chủng lợi khuẩn và khả năng phân hủy cellulose của nó để nâng cao khả năng tiêu hóa thức ăn
chăn nuôi và năng suất của vật nuôi.
Carboxymethyl cellulase (CMCase) là một loại enzyme endoglucanase, có khả năng thủy phân
các liên kt β-1,4-glycosidic bên trong phân tử cellulose, tạo ra cc đoạn cellulose ngắn hơn
(oligosaccharide) và cellobiose. Theo đó, vi khuẩn Bacillus có khả năng sản xuất CMCase và sử
dụng enzyme này để phân giải cellulose [16], một polysaccharide phức tạp và nguồn carbon dồi
dào trong tự nhiên có trong cây hành tím. Tuy nhiên, việc ứng dụng các chủng này để lên men hành
tím vẫn gặp khó khăn do yêu cu điều kiện sản xuất enzyme cao và cấu trúc cellulose phức tạp của
nguyên liệu [17]. Do đó, tối ưu hóa điều kiện sản xuất enzyme là chìa khóa để nâng cao hiệu quả
phân hủy cellulose và tăng cường sản xuất enzyme [18].
Nghiên cứu này nhằm mục đích tối ưu hóa điều kiện sản xuất enzyme cellulase từ chủng
Bacillus subtilis BSn5 (phân lập từ cơ quan tiêu hóa của gà bản địa), hướng đn việc lên men phân
hủy củ hành tím thành các thành phn dinh dưỡng và dược chất cao, từ đó tạo ra ch phẩm sinh
hc sử dụng cho chăn nuôi gia cm.
2. Vật liệu và phương pháp nghiên cứu
2.1. Vật liệu nghiên cứu
Chủng Bacillus subtilis BSn5 (Genbank ID: CP002468.1) (phân lập từ cơ quan tiêu hóa gà địa
phương với tiềm năng probiotic cao), được lưu tr tại Phòng thí nghiệm Vi sinh, Trường Đại hc
Nông lâm, Đại hc Hu, Việt Nam.
Chit xuất hành tím: Hành tím (Allium cepa L. var. aggregatum - NCBI Genbank ID:
NC_057575.1, 4-5 thng) được trồng an toàn sinh hc theo tiêu chuẩn Vietgap TCVN 11892-
1:2017 tại Điền Môn, Phong Điền, Thừa Thiên Hu. Sau khi rửa sạch, hành được ngâm 120 phút
trong dung dịch NaCl 5% để sát khuẩn. Sau đó, hành được khử trùng bằng đèn UV (30 mW/cm²,
15 phút) và sau đó được xay mịn bằng my xay sinh tố và để thu được chit xuất hành tím vô trùng.
Môi trường sản xuất enzyme lên men dạng lỏng gồm pepton, amonium sulfate, chit xuất nấm
men, kali dihydrophosphate, calcium cloride, magnesium sulfate heptahydrate, Tween-80, acid
citric, natri carboxymethylcellulose, nước cất, pH 5,0…

TNU Journal of Science and Technology
230(01): 474 - 482
http://jst.tnu.edu.vn 476 Email: jst@tnu.edu.vn
2.2. Phương pháp nghiên cứu
2.2.1. Thử nghiệm đơn yu tố sản xuất enzyme bằng phương pháp lên men
Ảnh hưởng của nguồn nitrogen: Lấy 2 mL huyền phù vi khuẩn của chủng B. subtilis BSn5 (~109
CFU/mL) và thêm vào 2 g/100 g pepton, 1 g/100 g pepton cộng với 1 g/100 g ammonium sulfate và
2 g/100 g ammonium sulfate làm nguồn nitrogen tương ứng. Trong cc môi trường sản xuất enzyme
khác nhau, các thành phn khc không thay đổi và mỗi nhóm được nuôi cấy song song 3 ln với tỷ
lệ nguyên liệu:nước là 1:4 (m/v) và 35oC trong 5 ngày, đo lượng enzyme hoạt động.
Ảnh hưởng của tỷ lệ nguyên liệu:nước: Lấy 2 mL huyền phù vi khuẩn của chủng B. subtilis
BSn5 (~109 CFU/mL) và thêm vào cc môi trường nuôi cấy sản xuất enzyme rắn khác nhau với tỷ
lệ thức ăn và nước là 1:2, 1:3, 1:4, 1:5 và 1:6 (m/v), trộn đều bằng rung, 3 mẫu song song trên mỗi
nhóm, nuôi cấy ở 35oC trong 5 ngày và đo hoạt tính của enzyme.
Ảnh hưởng của tỷ lệ carbon:nitrogen: Lấy 2 mL huyền phù vi khuẩn chủng B. subtilis BSn5
(~109 CFU/mL) và thêm vào môi trường nuôi cấy sản xuất enzyme rắn khác nhau với tỷ lệ carbon-
nitrogen là 5:1, 10:1, 20:1, 30:1 và 40:1 (m /m). Mỗi nhóm có 3 mẫu tương đương, với tỷ lệ nguyên
liệu:nước là 1:4 (m/v), nuôi cấy ở 35oC trong 5 ngày và đo hoạt tính của enzyme.
Ảnh hưởng của giá trị pH ban đầu: Lấy 2 mL huyền phù vi khuẩn của chủng B. subtilis BSn5
(~109 CFU/mL) cho vào môi trường nuôi cấy sản xuất enzyme rắn khác nhau với các giá trị pH
ban đu là 3,0, 4,0, 5,0, 6,0 và 7,0. Mỗi nhóm có 3 chất tương đương và nguyên liệu. Tỷ lệ nguyên
liệu:nước là 1:4 (m/v) và nuôi cấy ở 35oC trong 5 ngày và đo hoạt tính của enzyme.
Ảnh hưởng của nhiệt độ lên men: Lấy 2 mL huyền phù vi khuẩn của chủng B. subtilis BSn5
(~109 CFU/mL) cho vào 15 môi trường nuôi cấy rắn sản xuất enzyme trong cùng điều kiện. Mỗi
nhóm có 3 môi trường tương đương. Tỷ lệ nguyên liệu/nước là 1:4 (m/v). Sau khi nuôi cấy trong
5 ngày ở 35, 38 và 41oC, đo hoạt tính của enzyme.
Ảnh hưởng của thi gian lên men: Lấy 2 mL huyền phù vi khuẩn của chủng B. subtilis BSn5
(~109 CFU/mL) cho vào 15 môi trường nuôi cấy sản xuất enzyme trong cùng điều kiện. Mỗi nhóm
có 3 môi trường tương đương. Tỷ lệ nguyên liệu/nước là 1:4 (m/v) và ở 35oC.
Ảnh hưởng của nguồn carbon ph (glucose): Lấy 2 mL huyền phù vi khuẩn chủng B. subtilis
BSn5 (~109 CFU/mL) cho vào cc môi trường nuôi cấy sản xuất enzyme rắn khác nhau có hàm
lượng glucose 0,0, 0,5, 1,0, 1,5 và 2,0 g/100 g. Mỗi nhóm được nuôi cấy thành ba nhóm song song
với tỷ lệ nguyên liệu-nước là 1:4 (m/v) ở 35oC trong 6 ngày và đo hoạt độ enzyme.
2.2.2. Thí nghiệm kiểm chứng
Sự kt hợp tối ưu gia các kt quả kiểm tra bề mặt phản ứng đã được sử dụng để phân tích qu
trình phân hủy củ hành tím và đo hoạt động của enzyme CMCase.
2.2.3. Xác định các chỉ số nghiên cứu
Đưng chuẩn glucose: Thực hiện theo Luo và Wang [19]. Chuẩn bị 9 ống nghiệm với các thể
tích dung dịch glucose chuẩn 1,0 mg/mL ln lượt là 0,0; 0,2; 0,4; 0,6; 0,8; 1,0; 1,2; 1,4; 1,6 mL,
sau đó thêm nước cất đn 2,0 mL để tạo ra các nồng độ khác nhau. Tip theo, thêm 1,5 mL dung
dịch acid 3,5-dinitrosalicylic (DNS) và đun cch thủy trong 5 phút. Sau khi làm nguội, thể tích
được điều chỉnh đn 25 mL. Đo mật độ quang tại bước sóng 520 nm bằng máy quang phổ, sử dụng
mẫu trắng. Phương trình đường chuẩn glucose thu được là y = 0,6186x - 0,0008.
Xác định hot độ enzyme CMCase: Dựa theo mô tả của Fang và Xia [20]. Thêm 1,0 mL dung
dịch enzyme và 1,5 mL đệm natri carboxymethyl cellulose citrate vào 4 ống nghiệm. Ủ trong bể
nước ở 50°C trong 30 phút, sau đó dừng phản ứng bằng cch thêm 1,5 mL DNS, đun cch thủy
trong 5 phút và làm nguội. Đo mật độ quang ở bước sóng 520 nm và tính hoạt độ enzyme CMCase
theo công thức: CMCase (U/g) = (m₁ x V₁ x 5,56) / (V₂ x m₂ x t).
Xác định hàm lượng đưng glucose: Theo Wang và Bao [21], chuẩn bị 4 ống nghiệm, thêm 1,0
mL dung dịch enzyme và 1,5 mL DNS vào các ống số 2, 3 và 4. Đun cch thủy 5 phút, làm nguội
TNU Journal of Science and Technology
230(01): 474 - 482
http://jst.tnu.edu.vn 477 Email: jst@tnu.edu.vn
và điều chỉnh thể tích đn 25 mL. Đo mật độ quang ở bước sóng 520 nm và tính hàm lượng glucose
dựa trên đường chuẩn.
2.3. Phân tích thống kê
Các thử nghiệm được thực hiện ba ln độc lập và kt quả được biểu thị dưới dạng trung bình
(Mean) ± độ lệch chuẩn (SD). Phân tích thống kê bằng phn mềm IBM.SPSS (Phiên bản 22) với
oneway ANOVA, hậu kiểm bằng phép thử Tukey và được coi là có ý nghĩa ở mức α = 0,05. Sử
dụng phn mềm Design-Expert 13 để vẽ cc đường cong bề mặt phản ứng và bản đồ đường viền
giúp phân tích sự tương tc gia các bin và xc định điểm tối ưu.
3. Kết qu và bàn luận
3.1. Kết quả thử nghiệm đơn yếu tố về điều kiện sản xuất enzyme
3.1.1. Ảnh hưởng của nguồn nitrogen
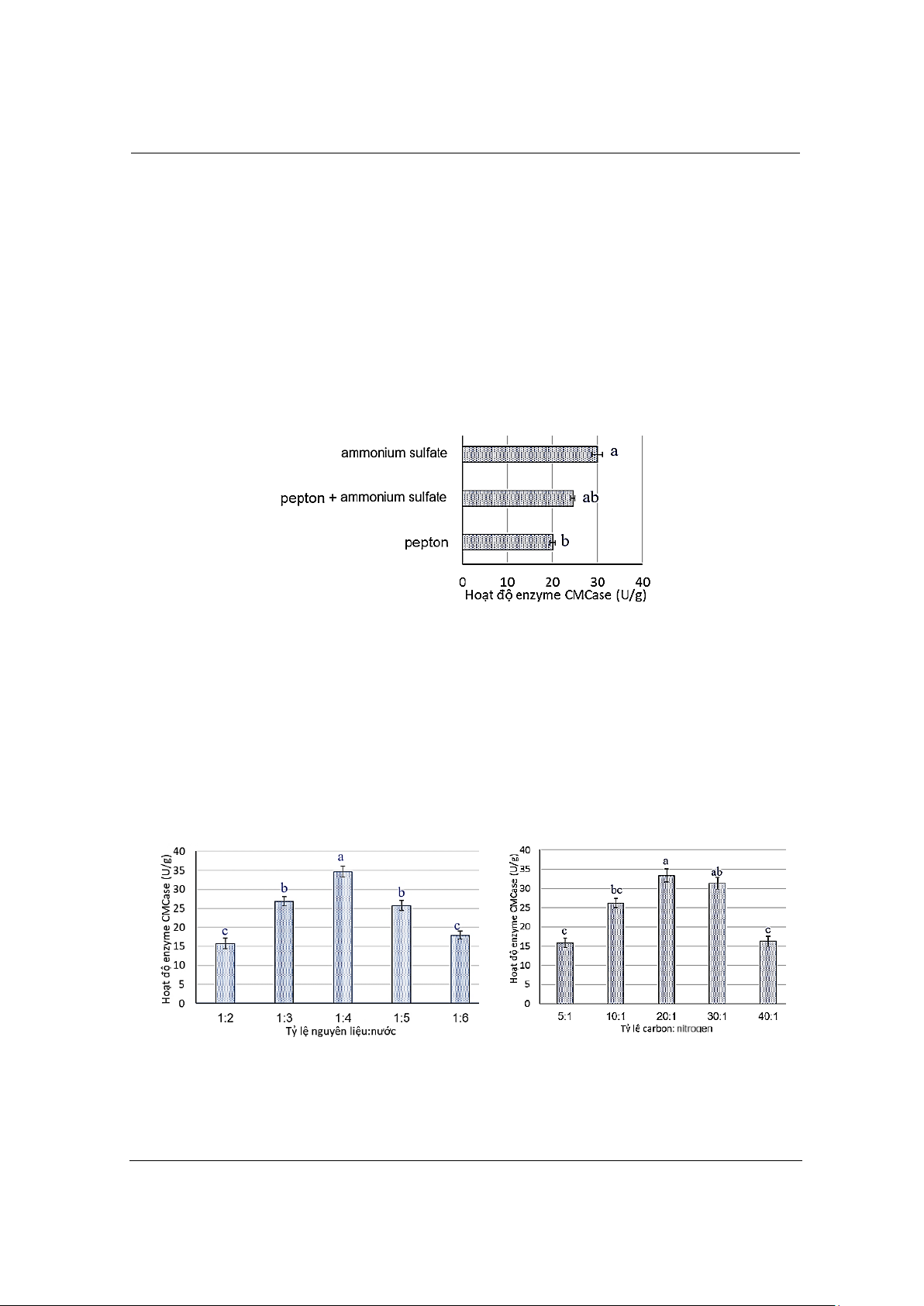
Hình 1. Ảnh hưởng của nguồn nitrogen đn quá trình sản xuất CMCase.
Giá trị c ch cái (a,b) khác nhau biểu thị sai khác c ngha thống kê (P<0,05)
Hình 1 cho thấy hoạt tính của enzyme CMCase bị ảnh hưởng bởi nguồn nitrogen được sử dụng.
Khi chỉ sử dụng peptone, hoạt độ enzyme thấp nhất (20,15 U/g). Khi kt hợp peptone và ammonium
sunfate, hoạt độ enzyme tăng nhẹ. Tuy nhiên, hoạt độ enzyme cao nhất (30,66 U/g) và cao hơn
đng kể (P=0,021) so với nguồn sử dụng peptone và đạt được khi chỉ sử dụng ammonium sunfate
làm nguồn nitrogen duy nhất. Điều này chỉ ra rằng chủng B. subtilis BSn5 có thể sử dụng cả nguồn
nitrogen hu cơ và vô cơ, nhưng nguồn nitrogen vô cơ (ammonium sunfate) mang lại hiệu quả sản
xuất enzyme CMCase tốt hơn. Do đó, ammonium sunfate, vừa rẻ vừa phù hợp cho sản xuất quy
mô lớn, đã được chn làm nguồn nitrogen duy nhất cho các thí nghiệm tip theo.
3.1.2. Ảnh hưởng của tỷ lệ nguyên liệu:nước
A
B
Hình 2. Ảnh hưởng của tỷ lệ nguyên liệu:nước (A) và tỷ lệ carbon-nitrogen (B) đn quá trình sản xuất
CMCase. Giá trị c ch cái (a,b,c) khác nhau biểu thị sai khác c ngha thống kê (P<0,05)
Có thể thấy trên Hình 2A, khi hàm lượng nước tăng lên, hoạt tính của enzyme CMCase tăng
dn và đạt giá trị tối đa khi tỷ lệ vật liệu-nước là 1:4 (m/v), sai khc có ý nghĩa thống kê (P<0,05)
với cc nghiệm thức khc. Khi tỷ lệ vật liệu-nước vượt quá 1:4 (m/v), hoạt tính của enzyme
TNU Journal of Science and Technology
230(01): 474 - 482
http://jst.tnu.edu.vn 478 Email: jst@tnu.edu.vn
CMCase có xu hướng giảm, từ 34,080 U/g xuống 19,157 U/g. Nguyên nhân là do nước là một trong
nhng điều kiện cn thit cho vi sinh vật phát triển. Hành tím hút nước, phồng lên và mềm ra, tạo
điều kiện thuận lợi cho chủng phân hủy cellulose B. subtilis BSn5 phát triển và chuyển hóa. Tuy
nhiên, khi hàm lượng nước quá cao, nồng độ của một số chất dinh dưỡng (một số cellulose và các
ion vô cơ) giảm, dẫn đn hoạt động của enzyme CMCase có xu hướng giảm. Pandey và cộng sự
(2000) nhấn mạnh rằng độ ẩm tối ưu là rất quan trng đối với sự phát triển của vi khuẩn trong môi
trường nuôi cấy lên men rắn (SFF), cân bằng cc điều kiện để tăng cường sản xuất enzyme mà không
gây ra sự suy giảm oxy [22]. Hölke và Lenz (2005) nhấn mạnh rằng tỷ lệ nước phù hợp là chìa khóa,
vì nó cho phép chuyển đổi chất nền hiệu quả trong khi ngăn ngừa sự pha loãng enzyme [23].
3.1.3. Ảnh hưởng của tỷ lệ carbon:nitrogen
Hình 2B cho thấy khi tỷ lệ carbon:nitrogen tăng dn thì hoạt tính của enzyme CMCase cũng
tăng dn, đạt giá trị tối đa khi tỷ lệ carbon:nitrogen ở khoảng 20:1 (m/m), hoạt độ enzyme CMCase
của nó bắt đu giảm đng kể (P<0,05), từ 33,367 U/g ở 20:1 (m/m) xuống 18,245 U/g ở 40:1 (m/m).
Điều này là do tỷ lệ carbon:nitrogen ảnh hưởng trực tip đn sự phát triển và trao đổi chất của
chủng. Lynd và cộng sự (2002) phát hiện ra rằng các chủng phân hủy cellulose cn mức nitrogen
thấp, vì nitrogen cao có thể ức ch sản xuất enzyme [24]. Nhu cu nitrogen thấp này hướng năng
lượng vào quá trình tổng hợp enzyme thay vì tăng trưởng t bào quá mức, giúp tăng hiệu quả [25].
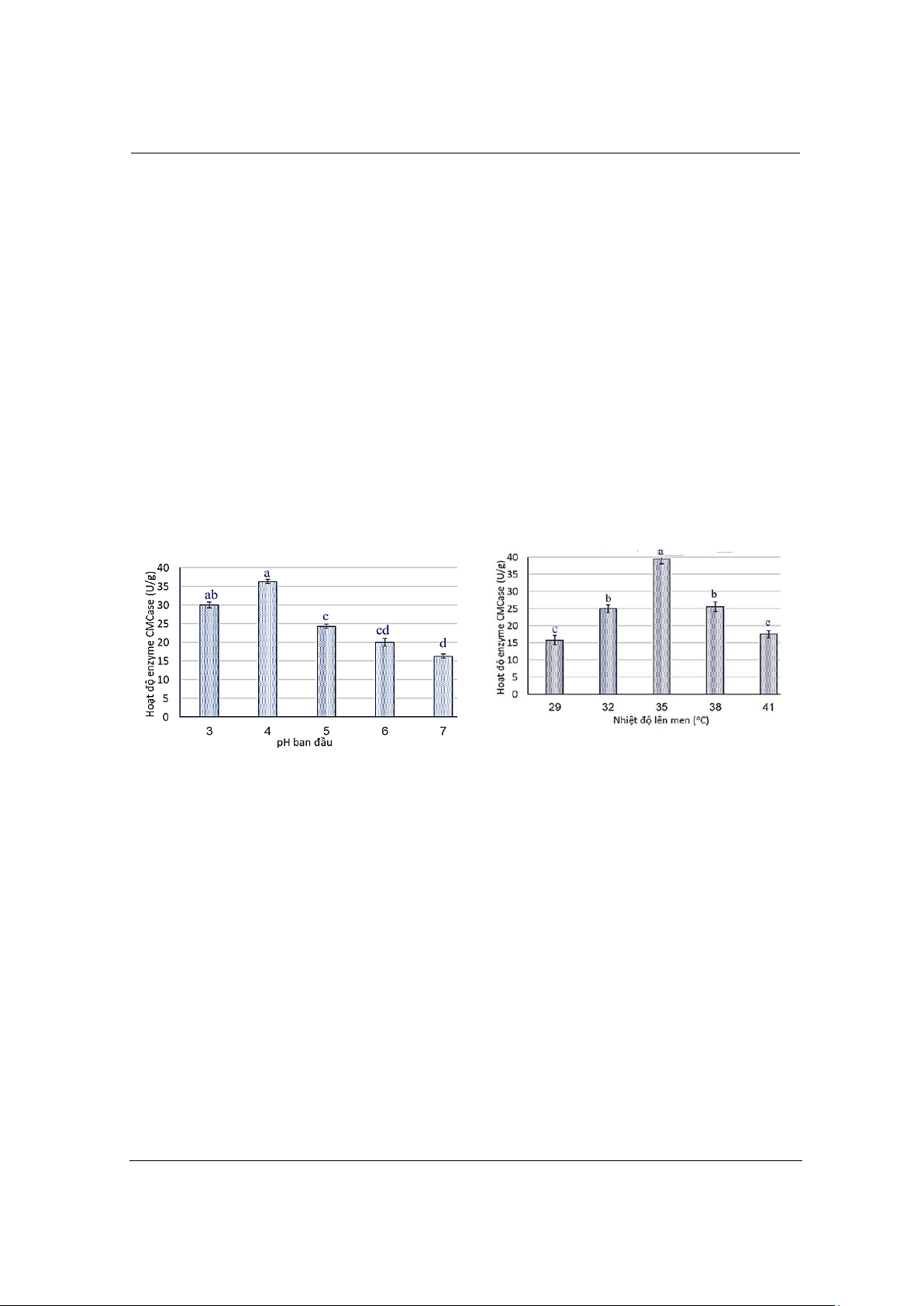
3.1.4. Ảnh hưởng của giá trị pH ban đầu
A
B
Hình 3. Ảnh hưởng của pH môi trưng ban đầu (A) và nhiệt độ lên men đn quá trình sản xuất CMCase
(B). Giá trị c ch cái (a-d) khác nhau biểu thị sai khác c ngha thống kê (P<0,05)
Hình 3A cho thấy khi giá trị pH ban đu tăng lên, hoạt động của enzyme CMCase tăng dn.
Hoạt tính enzyme CMCase đạt giá trị tối đa (36,33 U/g), sau khi tăng nhẹ từ pH 3,0 (30,032 U/g).
Khi giá trị pH ban đu lớn hơn 4,0 (pH 5-7), hoạt động của enzyme CMCase giảm đng kể (P<0,05)
từ 24,32 - 16,30 U/g. Cho thấy enzyme CMCase là enzyme có tính acid và ưa môi trường acid hơn,
thuận lợi hơn cho việc sản xuất, chuyển hóa và tích lũy enzyme CMCase của chủng này. Như vậy,
giá trị pH lên men tối ưu là 4,0.
3.1.5. Ảnh hưởng của nhiệt độ lên men
Hình 3B cho thấy khi nhiệt độ lên men tăng lên thì hoạt tính của enzyme CMCase cũng tăng
dn. Hoạt tính enzyme CMCase đạt giá trị tối đa ở nhiệt độ lên men 35oC (39,25 U/g). Khi nhiệt
độ lên men cao hơn ở mức 38 và 41oC và xuống thấp hơn ở mức 32, 29oC, hoạt độ enzyme CMCase
thấp hơn đng kể (P<0,05) so với nhiệt độ lên men ở 35oC. Như vậy, mỗi chủng vi khuẩn có nhiệt
độ lên men tối ưu để sản xuất enzyme. Ở điều kiện nhiệt độ này, chủng có thể sản xuất và tích lũy
enzyme ngoại bào tốt hơn. Nhiệt độ lên men tối ưu của chủng này là 35oC, cao hơn so với nhiệt độ
lên men thích hợp của các loại nấm mốc sản xuất CMCase thông thường (29 - 33 oC) [26].



















![Bài giảng Quản lý sản xuất cho kỹ sư: Chương 3 - Đường Võ Hùng [Chuẩn Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250812/oursky02/135x160/10441768298495.jpg)






