
Tổng quan về Lantan, Neodim và Prazeodim
Trong tự nhiên Lantan, Neodim và Prazeodim thường
tồn tại cùng nhau và chúng thường được gọi là các
nguuyên tố họ “đất hiếm”. Mặc dù trữ lượng của chúng
tương đối lớn (không kém Cu, I, Sb)nhưng chúng tồn tại
ở dạng phân tán nên chúng còn được gọi với cái tên là: “các nguyên tố phân tán”.
Vậy nguyên tố đất hiếm và những hợp chất của chúng có đặc điểm gì về tính chất
vật lý, tính chất hóa học,điều chế bằng cách nào.
1. Sơ lược về các nguyên tố đất hiếm
Các nguyên tố đất hiếm gồm Scandi, Ytri, Lantan và các Lantanoit. Các
Lantanoit (kí hiệu là : Ln) gồm 14 nguyên tố từ Xeri (STT : 58) đến Lutexi
(STT : 71) trong hệ thống tuần hoàn các nguyên tố hoá học, chúng chiếm
0,015% khối lượng vỏ trái đất. Các Lantanoit có số thứ tự chẵn có hàm lượng
lớn hơn các Lantanoit có số thứ tự lẻ .
Cấu hình electron chung của các nguyên tố đất hiếm:
1s22s22p63s23d104s24p64fm5s25p65dn6s2 hay [Xe] 4fm5dn6s2
(m : 2 ¸ 14, n : 0 hoặc 1)

Trong các Lantanoit, electron lần lượt điền vào obitan 4f của lớp thứ 3 từ
ngoài vào, trong khi lớp ngoài cùng có 2 electron (6s2) và lớp thứ 2 của các
nguyên tố có 8 electron (5s25p6).
Dựa vào cấu hình phân lớp 4f người ta phân họ các nguyên tố đất hiếm
ra làm hai nhóm :
Nhóm đất hiếm nhẹ
(Nhóm Xeri): Ce Pr Nd Pm S m Eu Gb
4f2 4f3 4f4 4f5 4f6 4f7 4f7 5d1
Nhóm đất hiếm nặng
(Nhóm Tecbi ):Tb Dy Ho Er Tm Yb Lu
4f7+2 4f7+3 4f7+4 4f7+5 4f7+6 4f7+7
4f7+45d1
Ở các nguyên tố thuộc phân nhóm nhẹ, mỗi obitan 4f mới được điền
vào 1 electron; còn ở phân nhóm nặng thì ở obitan 4f được điền thêm electron
thứ 2.

Các nguyên tố đất hiếm thường là các kim loại màu trắng bạc, dẻo, dễ
dát mỏng và kéo sợi. Chúng khá hoạt động hoá học, tan trong dung dịch HCl,
HNO3, H2SO4... tạo thành các halogenua, sunfua bền, phản ứng với H2, C,
N2, P,...
Các nguyên tố đất hiếm có khả năng tạo thành phức chất với nhiều phối
tử vô cơ và hữu cơ.
Số oxi hoá đặc trưng của các Latanit là +3 tương ứng với cấu hình lớp
ngoài cùng là: 5d16s2. Đó là kết quả của việc chuyển 1 electron từ phân lớp 4f
sang phân lớp 5d. Ngoài ra chúng còn có các số oxi hoá khác kém đặc trưng
hơn là: +2, +4 ( ở Ce và Pr nhưng ở Pr kém đặc trưng hơn Ce). Trong dung
dịch, các Lantanit tồn tại ở mức oxi hoá +3.
Các muối của La3+, Gb3+, Yb3+, Lu3+, Y3+ không màu, của Pr3+ có
màu xanh lá cây, của Nd3+ có màu tím hồng,v.v..
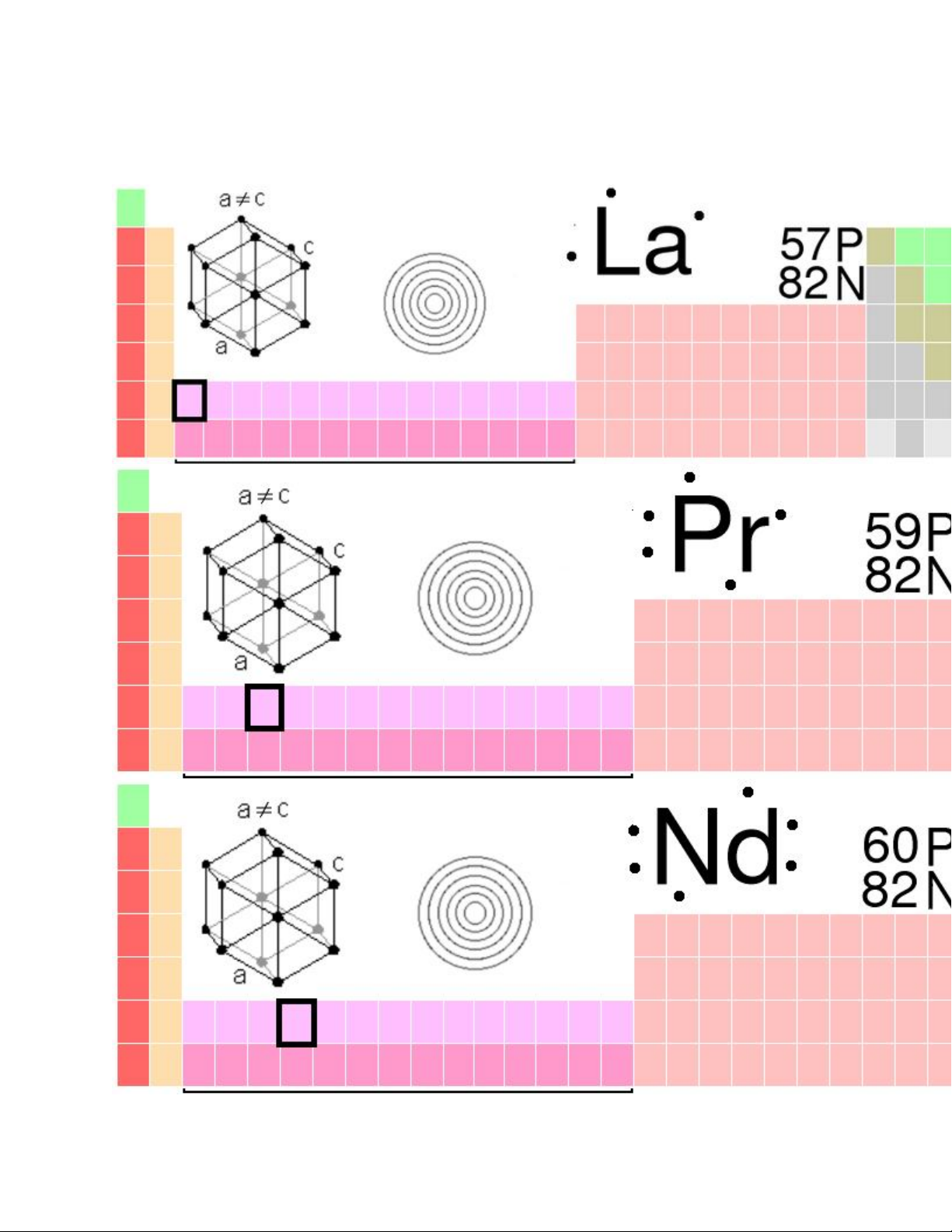
2. Sơ lược về Lantan, Neodim và Pr azeodim
Lantan, Neodim và Prazeodim là các nguyên tố thuộc phân nhóm nhẹ của các
nguyên tố đất hiếm.
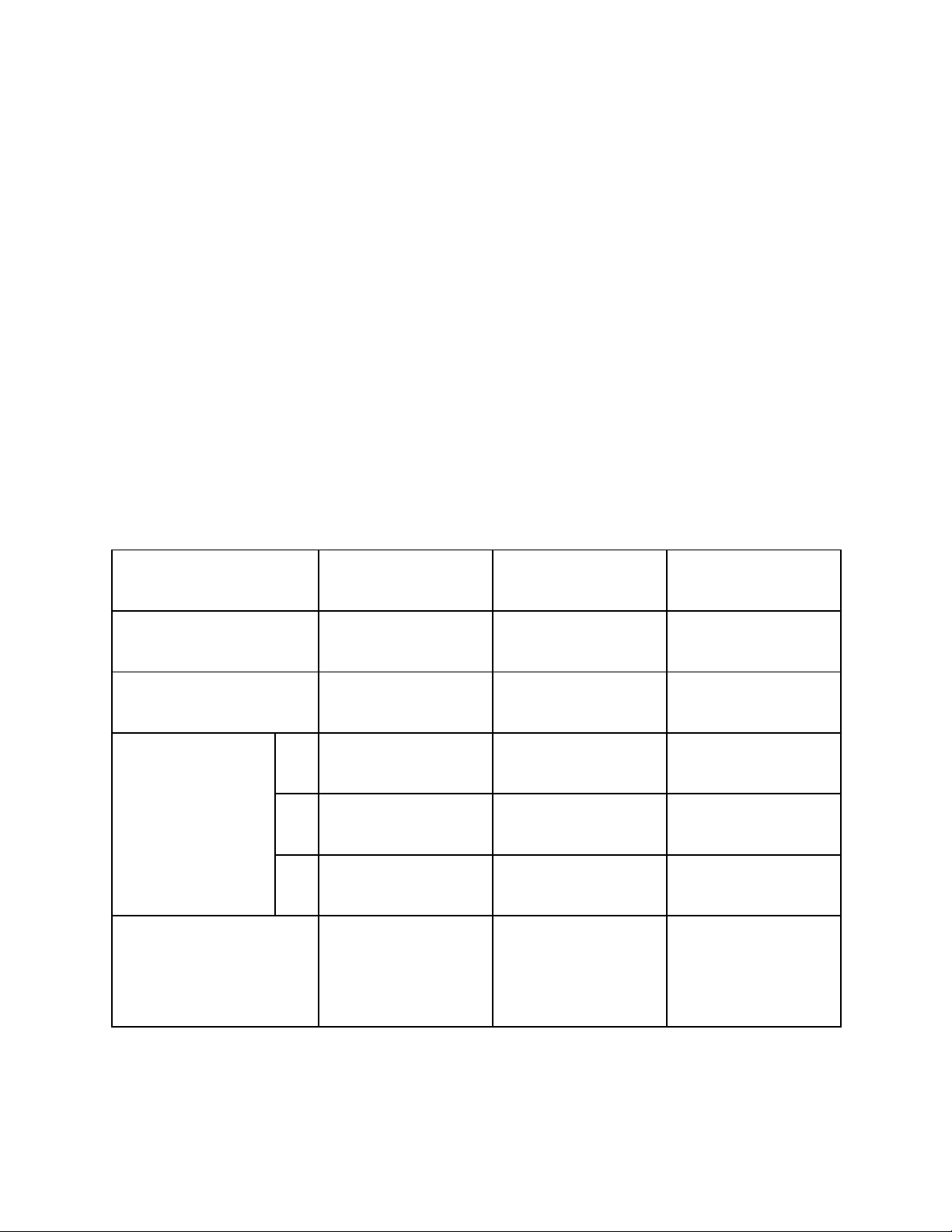
Một số thông tin quan trọng về ba nguyên tố này được mô tả trong bảng
sau( bảng 1.1):
Bảng 1.1: Các thông tin quan trọng của Lantan, Neodim, Prazeodim
Nguyên tố Lantan(La) Prazeodim(Pr) Neodim(Nd)
Số thứ tự 57 59 60
Cấu hình [Xe]5d16s2 [Xe]4f35d06s2 [Xe]4f45d06s2
Năng lượng ion
hóa
(eV)
I1 5.77 5.40 5.49
I2 11.33 10.34 10.71
I3 19.10 21.65 22.05
Khối lượng nguyên
tử (đvC)
138.19055 140.90765 144.24


























