
§1. Các khái niệm cơ bản
§2. Áp dụng nguyên lý I của nhiệt động học vào
hóa học
§3. Áp dụng nguyên lý II của nhiệt động học vào
hóa học

§1. Các khái niệm cơ bản
1. Hệ nhiệt động và môi trường:
-Hệ nhiệt động (gọi tắt là hệ): một vật thể hay một
nhóm vật thể được chọn làm đối tượng nghiên cứu.
Phần còn lại bao quanh hệ là môi trường.
-Các loại hệ:
*Hệ mở: giữa hệ và môi trường có trao đổi cả chất và năng
lượng
*Hệ kín: giữa hệ và môi trường không trao đổi chất chỉ trao
đổi năng lượng
* Hệ cô lập: giữa hệ và môi trường không trao đổi cả chất
và năng lượng

§1. Các khái niệm cơ bản
2. Trạng thái và thông số trạng thái
Trạng thái vĩ mô của hệ được xác định bởi tập hợp
các đại lượng vật lý: khối lượng, áp suất, nhiệt độ,
thể tích... Các đại lượng đó là các thông số trạng thái
-Thông số trạng thái dung độ (khuếch độ): Thông
số tỷ lệ với lượng chất
(vd: khối lượng, số mol, thể tích...)
-Thông số trạng thái cường độ: Thông số không tỷ
lệ với lượng chất (vd: nhiệt độ, áp suất...)
-Một hệ ở trạng thái cân bằng nếu các thông số
trạng thái của hệ không biến đổi theo thời gian.

§1. Các khái niệm cơ bản
3. Hàm trạng thái: Hàm trạng thái là hàm mà giá trị
của nó chỉ phụ thuộc vào các thông số trạng thái
Vd: n mol khí lý tưởng có hàm trạng thái
-Một thông số trạng thái cũng có thể là một hàm
trạng thái
Vd:
p.V = n.R.T
p.V
T = n.R
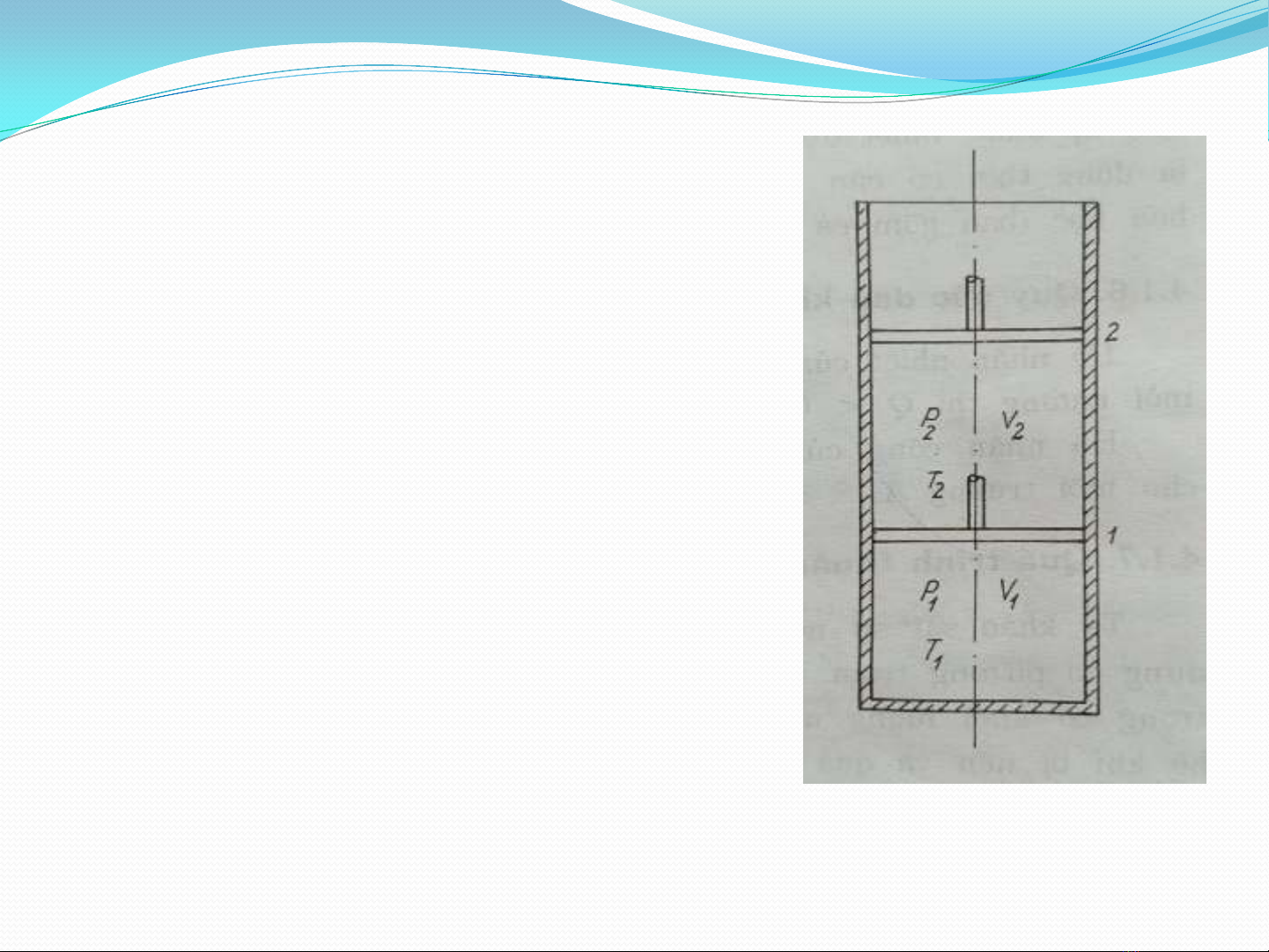
4. Quá trình và thông số quá trình.
- Quá trình: khối khí trong xi lanh
giãn nở từ vị trí 1→2. Nó nhận
nhiệt giãn nở sinh công
Q, A xuất hiện khi ta thực hiện
quá trình
A, Q là những thông số quá trình
→ Quá trình là sự thay đổi trạng
thái của hệ khi có sự thay đổi các
thông số trạng thái
Trạng thái 1 trạng thái 2


























