
CÁC LOẠI HIỆU ỨNG
1
GV: PHAN THỊ HOÀNG ANH
CHƯƠNG 2
PHÂN LOẠI
2
HIỆU ỨNG
(Effects)
HIỆU ỨNG ĐIỆN TỬ
(Electronic effects)
1. Hiệu ứng cảm ứng
(Inductive effects)
2. Hiệu ứng liên hợp
(Conjugation effects)
3. Hiệu ứng siêu liên hợp
(Hyperconjugation effects)
HIỆU ỨNG KHÔNG GIAN
(Steric effects)
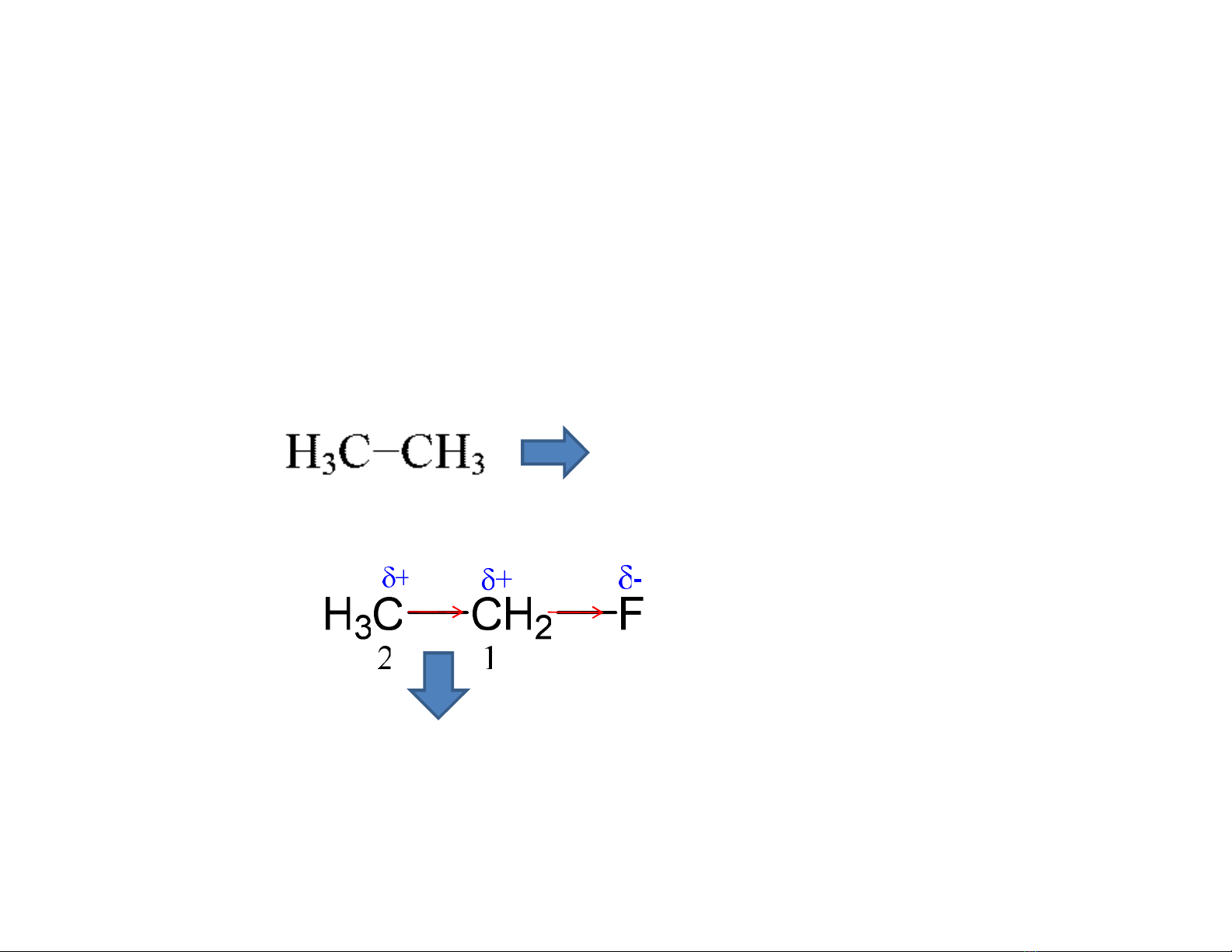
I. HIỆU ỨNG CẢM ỨNG
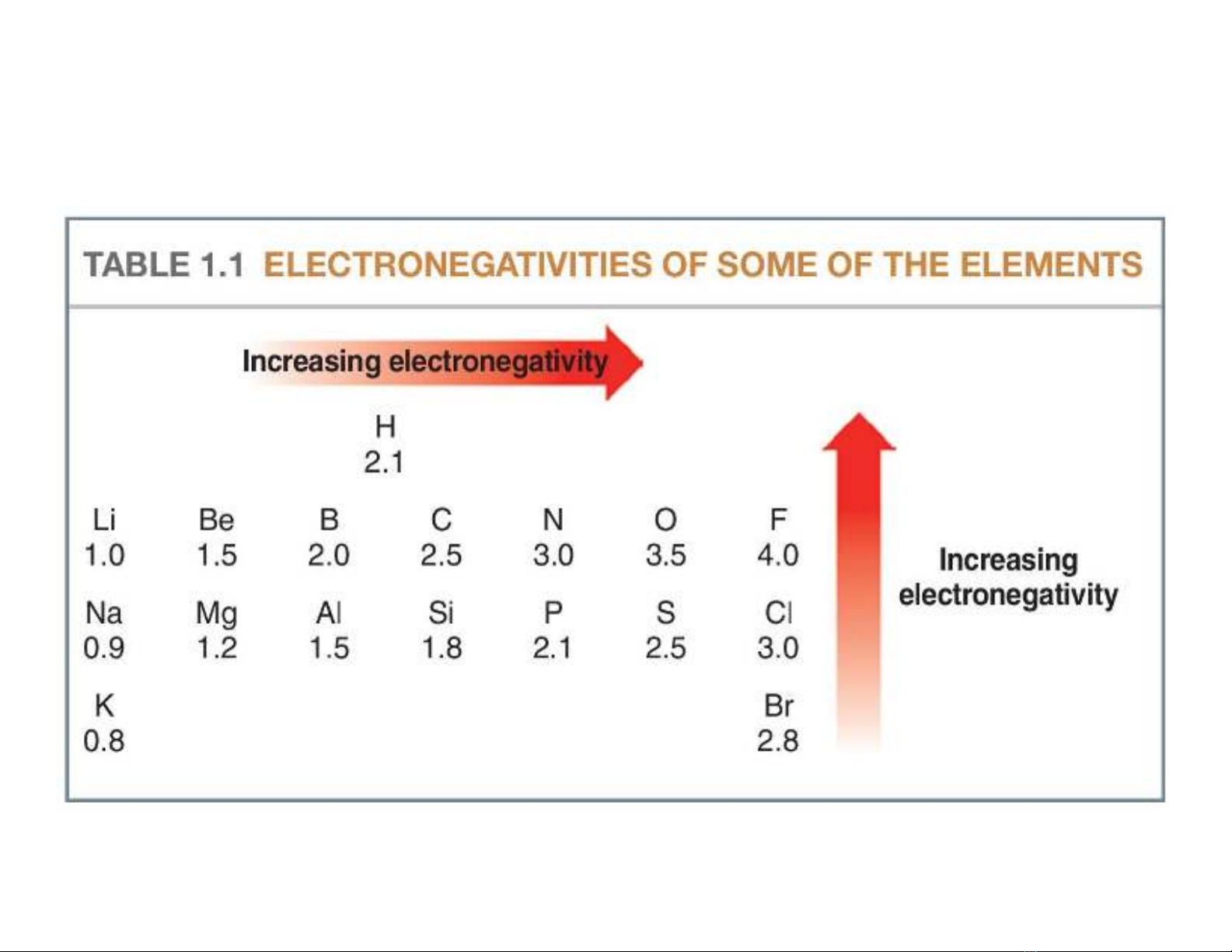
•Sự phân cực liên kết sgây ra do sự chênh lệch
về độ âm điện
•Ký hiệu: I(Inductive effect)
3
Liên kết C-C phân cực do ảnh hưởng của F
Liên kết C-C không phân cực
4
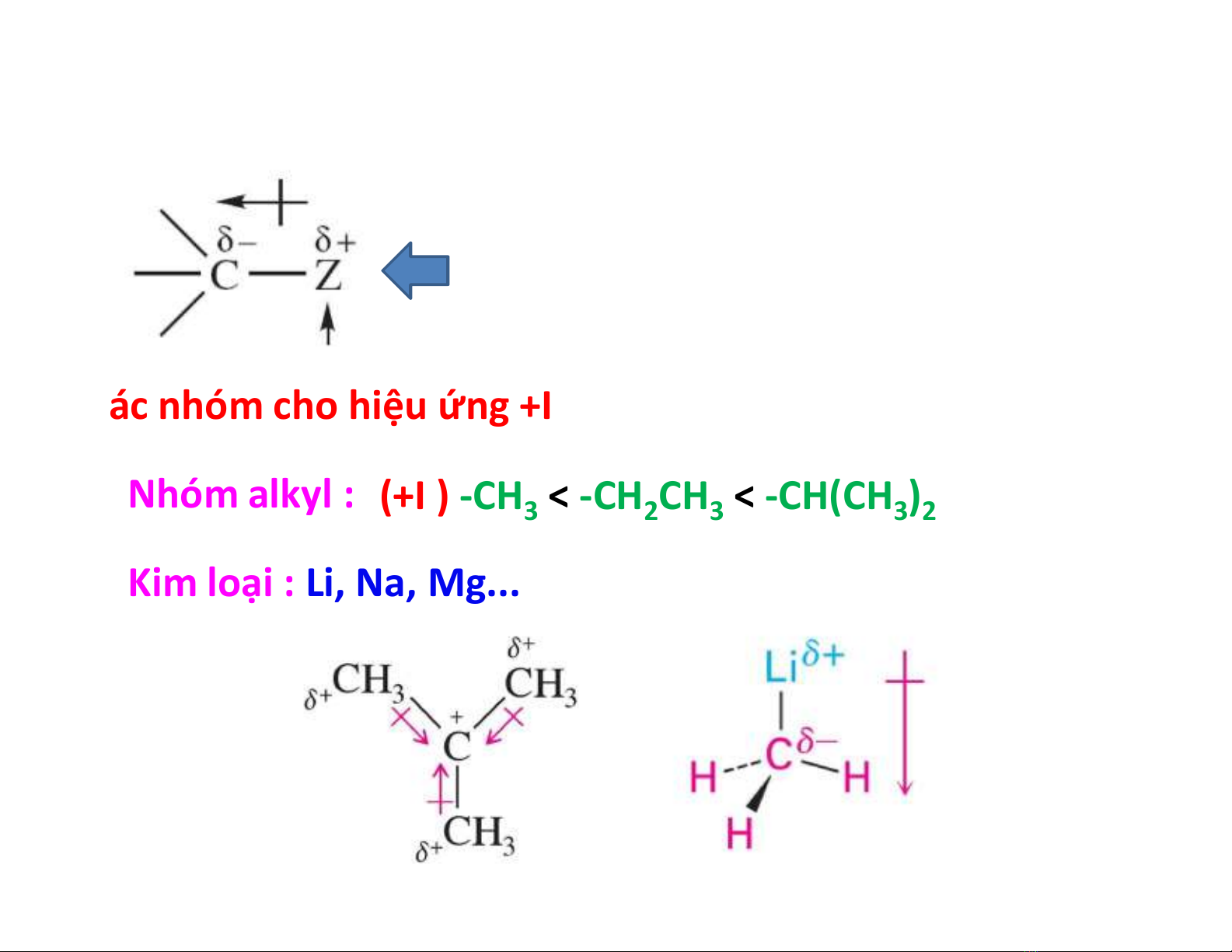
Hiệu ứng cảm ứng + (+I)
Các nhóm cho hiệu ứng +I
•Nhóm alkyl :
•Kim loại : Li, Na, Mg...
5
(+I ) -CH3< -CH2CH3< -CH(CH3)2< -C(CH3)3
Z có độ âm điện nhỏ hơn C
e lk bị
hút về phía C
Z gây ra hiệu ứng +I













![Tài liệu Hướng dẫn thực tập môn Hóa nước [Chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251231/kimphuong1001/135x160/22661767942303.jpg)
![Đề cương ôn tập Hóa sinh [chuẩn nhất/chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251231/tomhum321/135x160/93461767773134.jpg)











