
1
BÀI GI NG CHUYÊN Đ Ả Ề
HÓA H U CỮ Ơ
Dùng cho các l p h c hèớ ọ
Gi ng viên: Nguy n Th Hi nả ễ ị ể
B môn Hóa h c, khoa Môi tr ngộ ọ ườ

2
Chuyên đ 3: D N XU T HALOGEN ề Ẫ Ấ
VÀ ANCOL-PHENOL
N i dung:ộ
1. Các khái ni mệ
2. Các ph n ng đi u ch ả ứ ề ế
3. Ph n ng th ái nhân c a d n xu t halogen Sả ứ ế ủ ẫ ấ N1 và
SN2
4. Ph n ng tách HX (X: halogen, OH)ả ứ
5. Tính linh đng c a H trong nhóm –OHộ ủ
6. Ph n ng oxi hóa ancolả ứ

3
1. Các khái ni m:ệ
HCHC trong phân t có 1 ho c nhi u nguyên t c a 1 ho c ử ặ ề ử ủ ặ
nhi u nguyên t halogen.ề ố
Ví d : CHụ3Cl ; CHCl3 ; CH2=CH-Cl ; C6H5-Br ;
+ Ancol:
HCHC trong phân t có nhóm ch c OH liên k t tr c ti p v i ử ứ ế ự ế ớ
nguyên t cacbon no.ử
Ví d : ancol no: ụCH3-OH , CH3-CH2-OH,
ancol không no CH2=CH-CH2-OH,
ancol th m: Cơ6H5-CH2-OH
+ D n xu t halogenẫ ấ :
+ B c c a dx halogen và ancol: ậ ủ Là b c c a nguyên t cacbon ậ ủ ử
liên k t v i nhóm halogen hay nhóm OH đó.ế ớ
Ancol vinylic
Ancol benzylic
4
HCHC trong phân t có nhóm ch c OH liên k t tr c ti p v i ử ứ ế ự ế ớ
nguyên t cacbon c a vòng th m (đi n hình là vòng benzen).ử ủ ơ ể
C6H5-OH, p-CH3-C6H4-OH, p-CH2=CH-C6H4-OH
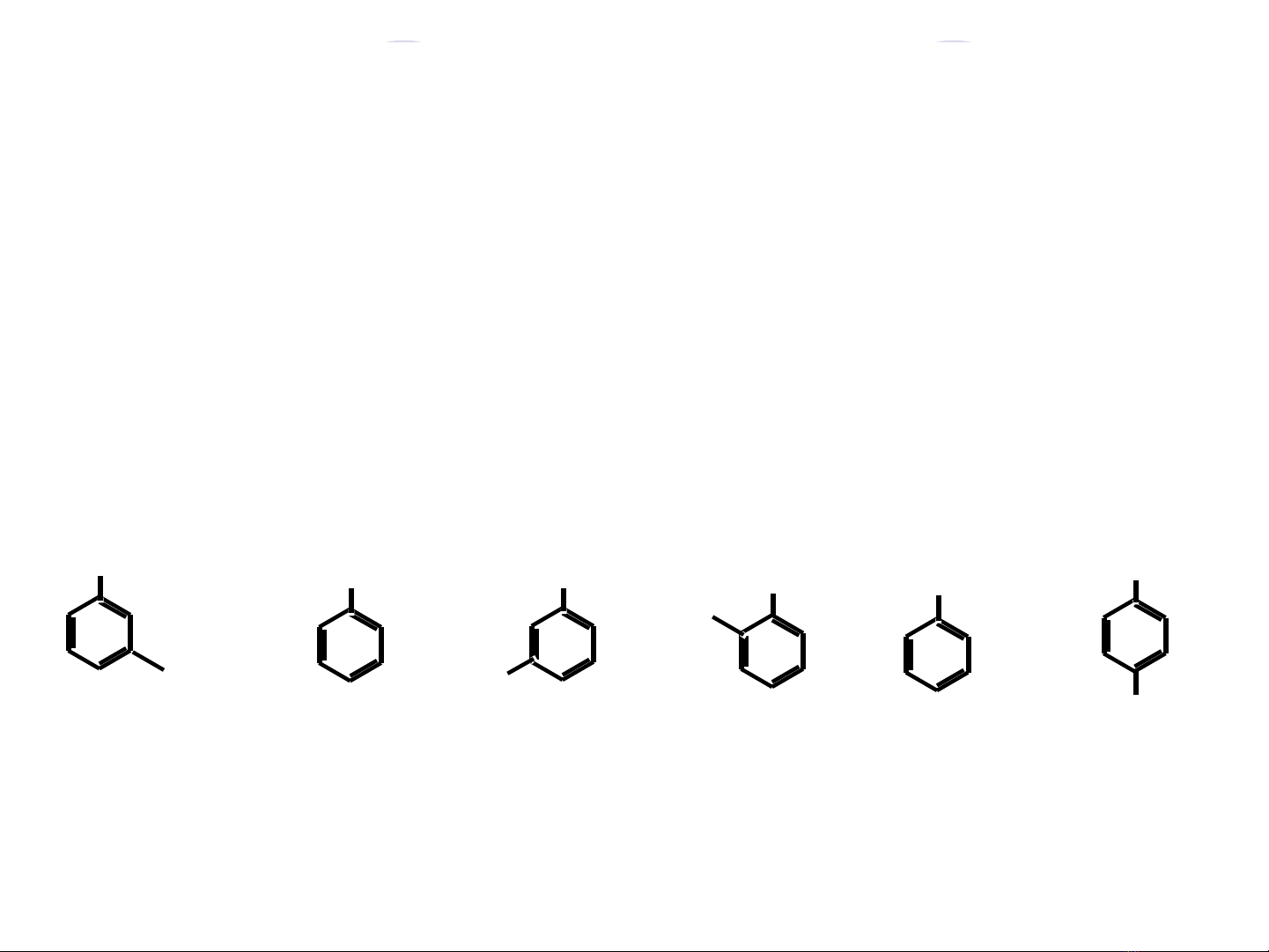
Nh n d ng phenol và ancol th m:ậ ạ ơ
+ Phenol:
CH2OH
CH3
OH
CH
3
OH CH2OH
OH
H3C
OH
H3C
Ancol
th mơPhenol Phenol Phenol Phenol
Ancol
th mơ

5
+ Phân lo i ancolạ:
Ancol đn ch cơ ứ : h p ch t có có 1 nhóm OH ợ ấ
liên k t v i nguyên t C no.ế ớ ử
VD: CH3OH; C6H5CH2OH; CH2=CH-CH2-OH
Ancol đa ch cứ: h p ch t có t 2 nhóm OH ợ ấ ừ
tr lên liên k t v i các nguyên t C no.ở ế ớ ử
VD: HO-CH2-CH2-OH; HO-CH2-CH2-CH2-OH
Poliancol: ancol đa ch c có nhi u nhóm OH ứ ề
liên k t v i các nguyên t C c nh nhau.ế ớ ử ạ
VD: HO-CH2-CH2-OH




![Bài giảng Hóa hữu cơ 1: Phần 2 - ĐH Võ Trường Toản (GV. Nguyễn Hoàng Sơn) [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230606/loivokiet/135x160/802300288.jpg)


![Bài giảng Hóa hữu cơ 1: Phần 1 - ĐH Võ Trường Toản (GV. Lê Vinh Bảo Châu) [Chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2023/20230606/loivokiet/135x160/1932011819.jpg)


















