
Ch ng IIIươ
CÂN B NG HÓA H CẰ Ọ
I. Đnh lu t tác d ng kh i l ng và h ng s cân b ng ị ậ ụ ố ượ ằ ố ằ
II. Cân b ng hoá h c trong h d thằ ọ ệ ị ể
III. Các y u t nh h ng đn cân b ng hoá h cế ố ả ưở ế ằ ọ
IV. Đnh lý nhi t Nernstị ệ
V. Các ph ng pháp xác đnh h ng s cân b ngươ ị ằ ố ằ
VI. Cân b ng hóa h c trong h th cằ ọ ệ ự

I. ĐNH LU T TÁC D NG KH I L NG VÀ Ị Ậ Ụ Ố ƯỢ
H NG S CÂN B NG Ằ Ố Ằ
1. N I DUNG ĐNH LU TỘ Ị Ậ
+ +
1
2
k
k
bB dD gG rR
Xét ph n ng đng th : ả ứ ồ ể
T c đ p/ thu n:ố ộ ư ậ
T c đ p/ ngh ch: ố ộ ư ị
2 2
g r
G R
v k C C=
1 1
b d
B D
v k C C=
05/18/22 2607010 - Ch ng 3ươ

+ +
1
2
k
k
bB dD gG rR
Ban đu vầ1 > v2, sau đó v1 gi m d n, vả ầ 2 tăng lên.
Khi v1 = v2 thì ph n ng đt cân b ng. Lúc đó, ta ả ứ ạ ằ
đc: ượ
1 2
b d g r
B D G R
k C C k C C=
1
2
g r
G R
Cb d
B D cb
k C C
Kk C C
� �
= =�� �
� �
Kc đc g i là ượ ọ H NG S CÂN B NGẰ Ố Ằ c a p . ủ ư
Giá tr c a h ng s cân b ng đc tr ng cho cân ị ủ ằ ố ằ ặ ư
b ng c a ph n ng đi u ki n xác đnh, nó không ằ ủ ả ứ ở ề ệ ị
thay đi khi thay đi n ng đ ch t p/ . ổ ổ ồ ộ ấ ư
05/18/22 3607010 - Ch ng 3ươ

HI, %
t (phuùt)
0
20
40
60
80
100
25 50 75 100
H + I = 2HI
22
2HI = H + I
2
2
Hình 3.1. Cân b ng hóa h c đt đc t hai phía ằ ọ ạ ượ ừ
thu n và ngh ch c a ph n ng Hậ ị ủ ả ứ 2 + I2 = 2HI
05/18/22 4607010 - Ch ng 3ươ
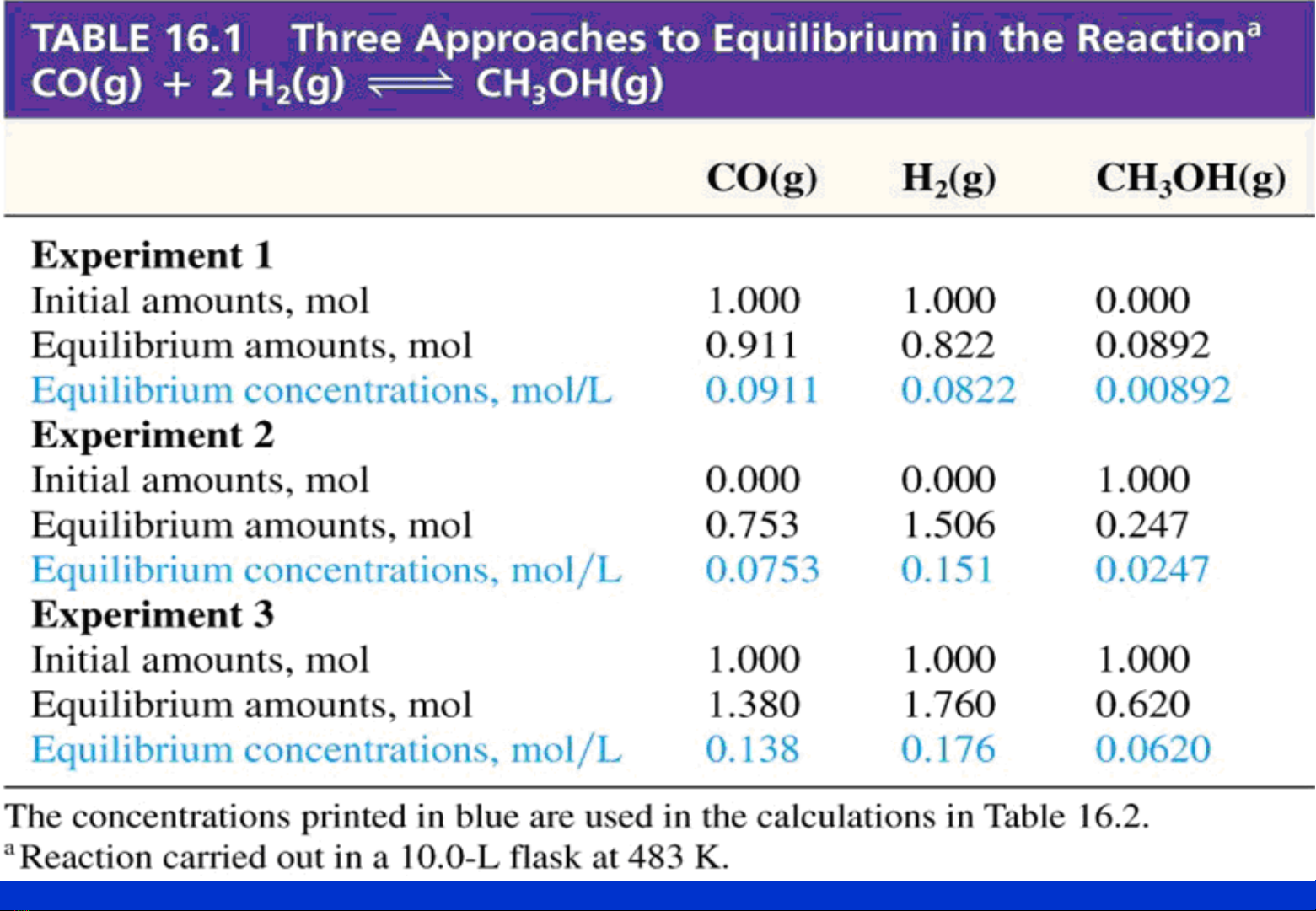
05/18/22 5607010 - Ch ng 3ươ

![Bài giảng Hóa lý thực phẩm [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250716/kimphuong1001/135x160/849_bai-giang-hoa-ly-thuc-pham.jpg)
![Bài giảng Hóa lý 1: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250704/tiepnguyen438@gmail.com/135x160/6631751621117.jpg)



![Bài giảng Nhiệt động lực học hóa học [chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2024/20241106/vipanly/135x160/371730886770.jpg)



















