
1
CH NG 5ƯƠ
S V N CHUY N Đi N TÍCHỰ Ậ Ể Ệ
2
N i dungộ
5.1. Khái ni m c b nệ ơ ả
5.2. Đ d n đi nộ ẫ ệ
5.3. Ph ng pháp đo đ d n đi n và ng d ngươ ộ ẫ ệ ứ ụ
5.4. Linh đ ion và linh đ ion H+ - OH-ộ ộ
5.5. Quan h đ d n đi n – t c đ chuy n v nệ ộ ẫ ệ ố ộ ể ậ
5.6. S chuy n v n c a các ionố ể ậ ủ
5.7. Đ nh lu t gi i h n Debye – Huckelị ậ ớ ạ
3
V t th cùng lo iậ ể ạ
5.1. Khái ni m c b nệ ơ ả
5.1.1. V n chuy n đi n tíchậ ể ệ
Ion – ion
Đi n t - đi n tệ ử ệ ử
Thay đ i thành ph n hóa h cổ ầ ọ
Khi d n đi n, t i b m t ti p xúcẫ ệ ạ ề ặ ế
Ph n ng hóa h c x y raả ứ ọ ả
V t th khác lo iậ ể ạ
Ion – đi n tệ ử
Đi n t - ionệ ử
4
üNh ng dung d ch đi n ly, ữ ị ệ
ch t đi n ly nóng ch y, các ấ ệ ả
khí ion hóa.
üD n đi n do s chuy n v n ẫ ệ ự ể ậ
c a các ion. ủ
5.1.2. Phân lo i dây d nạ ẫ
D a vào b n ch t d n đi n,ự ả ấ ẫ ệ
FARADAY chia thành 2 lo iạ
Dây d n lo i 1ẫ ạ Dây d n lo i 2ẫ ạ
üNh ng dây làm b ng kim lo i (đ ng, ữ ằ ạ ồ
b c, nhôm…) hay bán d n.ạ ẫ
üD n đi n do s d ch chuy n c a các ẫ ệ ự ị ể ủ
đi n t (electron) và l tr ngệ ử ỗ ố
5.1. Khái ni m c b nệ ơ ả
5
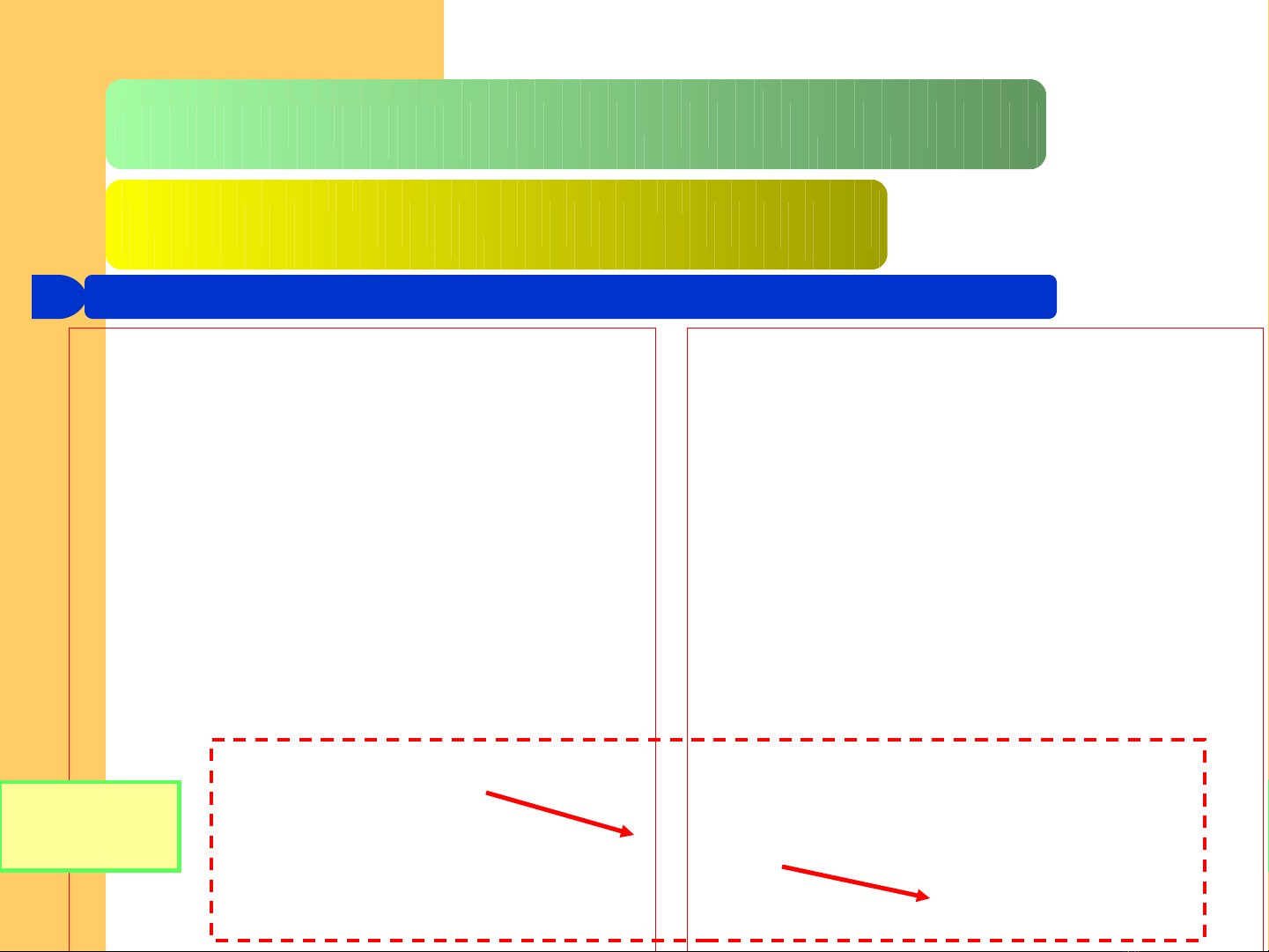
lC c âm (catod)ự
+ Electron chuy n t đi n c c ể ừ ệ ự
(n i c c ÂM ngu n đi n) đ n ố ự ồ ệ ế
ion (trong dung d ch)ị
+ Ph n ng kh x y raả ứ ử ả
Cu2+ + 2e = Cu
Fe3+ + e = Fe2+
2H2O + 2e = H2 + 2OH-
lC c d ng (anod)ự ươ
+ Electron chuy n t ion (trong ể ừ
dung d ch) đ n đi n c c (n i c c ị ế ệ ự ố ự
D NG ngu n đi n)ƯƠ ồ ệ
+ Ph n ng kh x y raả ứ ử ả
4OH- = O2 + 2H2O + 4e
Fe2+ = Fe3+ + e
Zn = Zn2+ + 2e
5.1.3. S đi n phânự ệ
5.1. Khái ni m c b nệ ơ ả
T ngổ
quá trình
Dây d n lo i 1ẫ ạ
(ANOD)
Dây d n lo i 1ẫ ạ
Dây d n lo i 2ẫ ạ (CATOD)
q
q

![Bài giảng Hóa lý thực phẩm [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250716/kimphuong1001/135x160/849_bai-giang-hoa-ly-thuc-pham.jpg)
![Bài giảng Hóa lý 1: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250704/tiepnguyen438@gmail.com/135x160/6631751621117.jpg)



![Bài giảng Nhiệt động lực học hóa học [chuẩn SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2024/20241106/vipanly/135x160/371730886770.jpg)






![Tài liệu Hướng dẫn thực tập môn Hóa nước [Chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251231/kimphuong1001/135x160/22661767942303.jpg)
![Đề cương ôn tập Hóa sinh [chuẩn nhất/chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251231/tomhum321/135x160/93461767773134.jpg)











