
Chương 7
Cấu trúc
acid amin và protein
1

Nội dung
Đại cương
Acid amin
Peptide
Protein
2

1. ĐẠI CƯƠNG
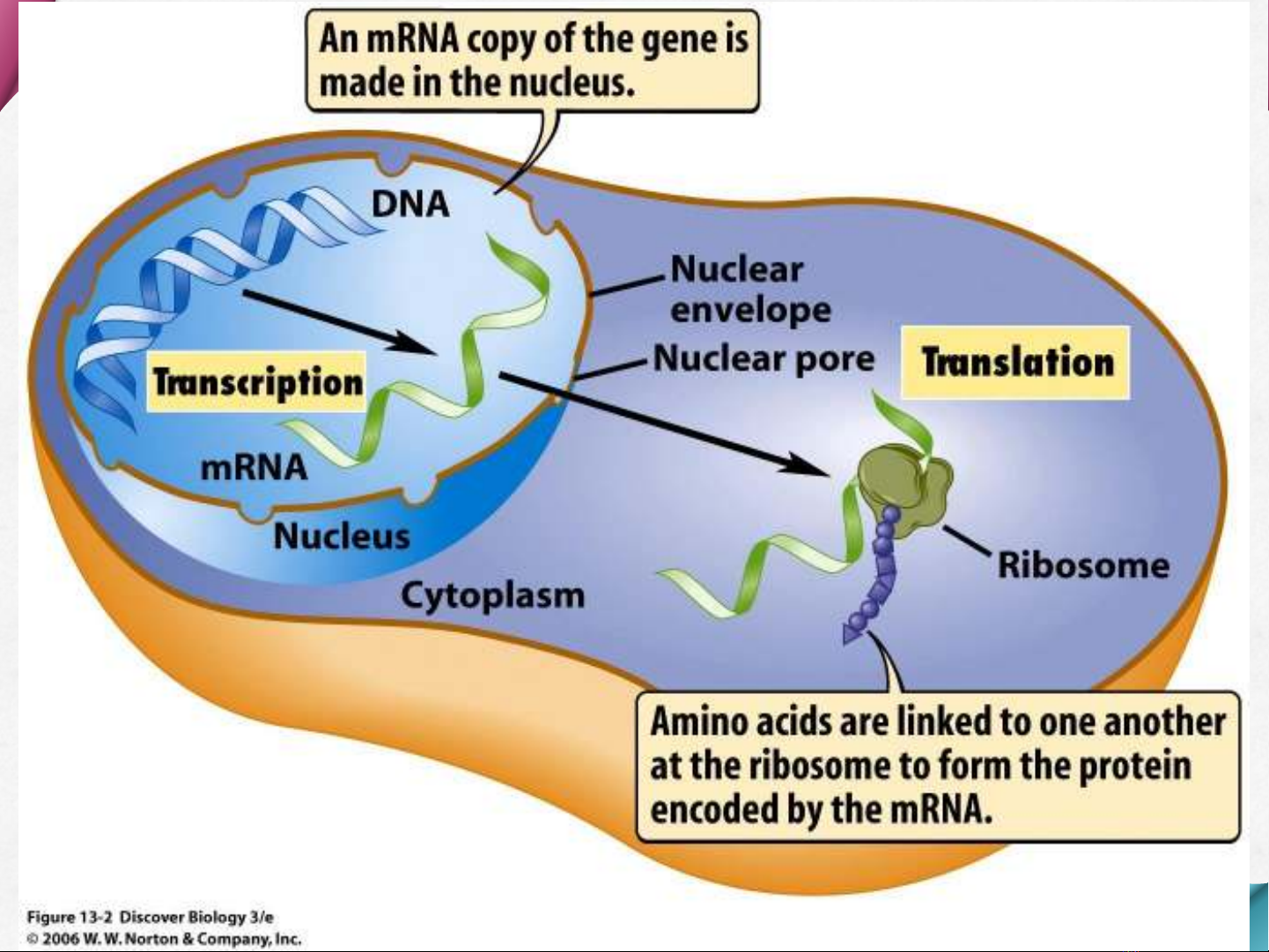

Đại cương
Protein là thành phần cơ bản của tế bào, là
nguyên liệu cần thiết để tổng hợp những
thành phần cấu trúc của cơ thể
Là enzym giữ nhiệm vụ xúc tác các quá
trình chuyển hóa
Được cấu tạo bởi nhiều acid amin kết hợp
với nhau bằng liên kết peptide



















![Hướng dẫn giải chi tiết bài tập phân li, phân li độc lập: Tài liệu [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251204/lethu2868@gmail.com/135x160/84711764814448.jpg)

