TUY N T P CÁC BÀI T P H U CỂ Ậ Ậ Ữ Ơ
Câu 1
1) Hôïp chaát höõu cô X coù caáu taïo khoâng voøng, coù coâng thöùc phaân töû C4H7Cl
vaø coù caáu hình E. Cho X taùc duïng vôùi dung dòch NaOH trong ñieàu kieän ñun
noùng thu ñöôïc hoãn hôïp saûn phaåm beàn coù cuøng coâng thöùc C4H8O . Xaùc ñònh
caáu truùc coù theå có cuûa X.
2) Cho buten – 2 vaøo dd goàm HBr , C2H5OH hoaø tan trong nöôùc thu ñöôïc caùc chaát
höõu cô gì ? Trình baøy cô cheá phaûn öùng taïo thaønh caùc chaát treân .
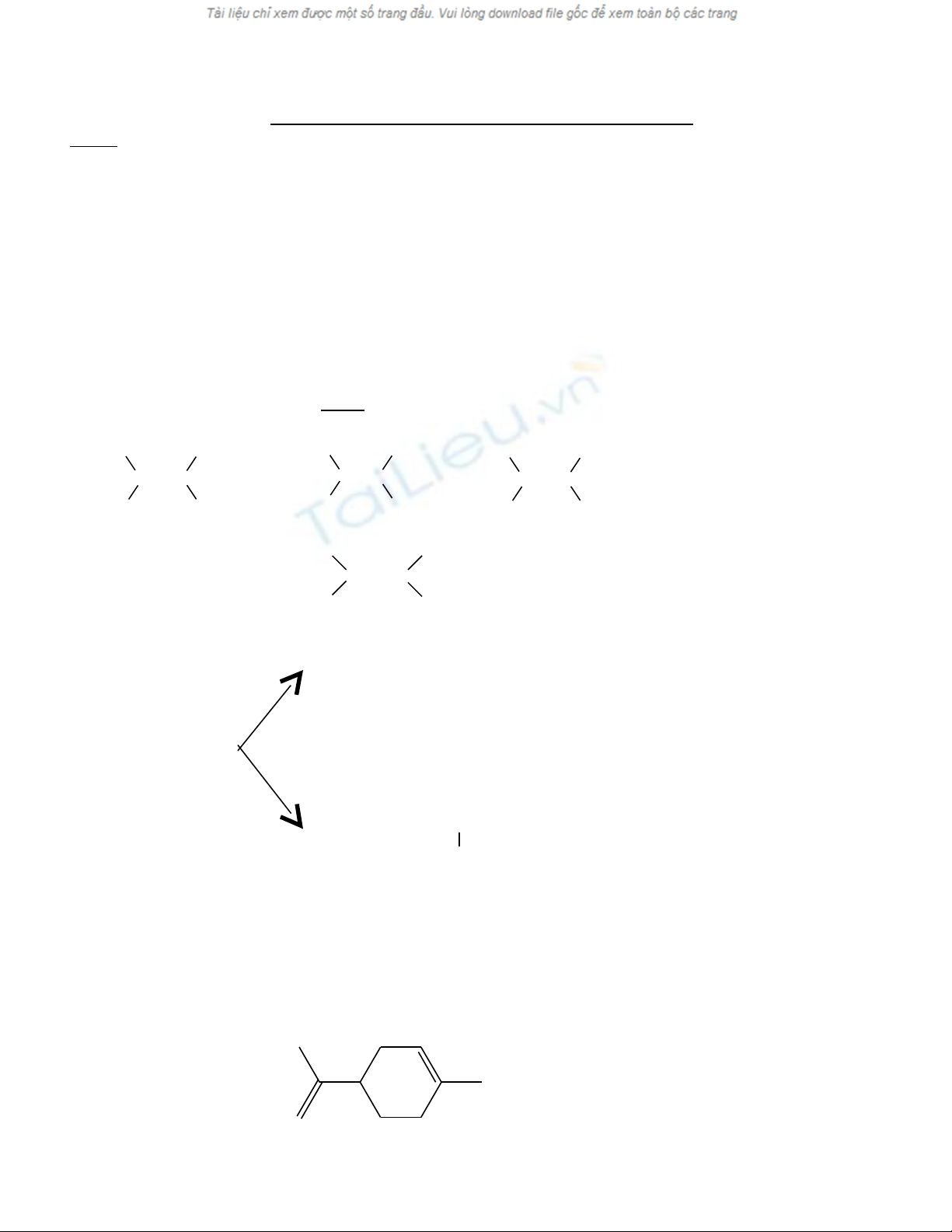
3) Phân tích 1 terpen A có trong tinh d u chanh thu đ c k t qu sau: C chi m 88,235% v kh i l ng,ầ ượ ế ả ế ề ố ượ
kh i l ng phân t c a A là 136 (đvC). A có kh năng làm m t màu dd Brố ượ ử ủ ả ấ 2 , tác d ng v i Brụ ớ 2 theo t lỉ ệ
mol 1:2, không tác d ng v i AgNOụ ớ 3/NH3. Ozon phân hoàn toàn A t o ra 2 s n ph m h u c : anđehitfomicạ ả ẩ ữ ơ
và 3-axetyl-6-on heptanal. Xác đ nh công th c c u t o c a A. Xác đ nh s đ ng phân l p th (n u có).ị ứ ấ ạ ủ ị ố ồ ậ ể ế
Cho C = 12; H = 1.
Gi iả
1. ÖÙng vôùi caáu hình E thì C4H7Cl coù 3 caáu truùc
CH3 CH3 C2H5 H CH3 H
C = C C = C
H Cl H Cl H CH2Cl
(1) (2) (3)
X + dung dich NaOH , tV0c thu đ c hôn h p san phâm bên ượ W ợ W W X
Vây câu truc cua X la : HV Y Y W X 3C H
C = C
H CH2Cl
.2. CH3CH = CHCH3 + H+
→
3 2 3
CH CH C HCH
+
CH3CH2CHBrCH3
3 2 3
CH CH C HCH
+
2
H O
→
3 2 3 2 3 2 3
( ) ( )
H
CH CH CH CH O H CH CH CH OH CH
+
+
−
→
3 2 3 2 5 3 2 3 2 5
( ) ( )
H
CH CH CH CH O C H CH CH CH CH OC H
+
+
−
→
H
3. Xác đ nh công th c c u t o c a A. Xác đ nh s đ ng phân l p th (n u có) ị ứ ấ ạ ủ ị ố ồ ậ ể ế
Đ t A: CặxHy
x : y = (88,235:12) : 11,765 = 10 : 16 ⇒ CT th c nghi m (Cự ệ 10H16)n
MA = 136 ⇒ CTPT A : C10H16 (s lk ốπ + s vòng = 3) ố
A tác d ng Brụ2 theo t l mol 1:2 ỉ ệ ⇒ A có 2 liên k t ếπ và 1 vòng
A không tác d ng v i AgNOụ ớ 3/NH3 ⇒ A không có n i ba đ u m chố ầ ạ
Ozon phân hoàn toàn A t o ra 2 s n ph m h u c : anđehitfomic và 3-axetyl-6-on heptanal ạ ả ẩ ữ ơ
⇒ CTCT A:
CH
3
*
A có 1 C* nên s đ ng phân l p th là 2ố ồ ậ ể
C = C
Br-
C2H5OH
Câu 2
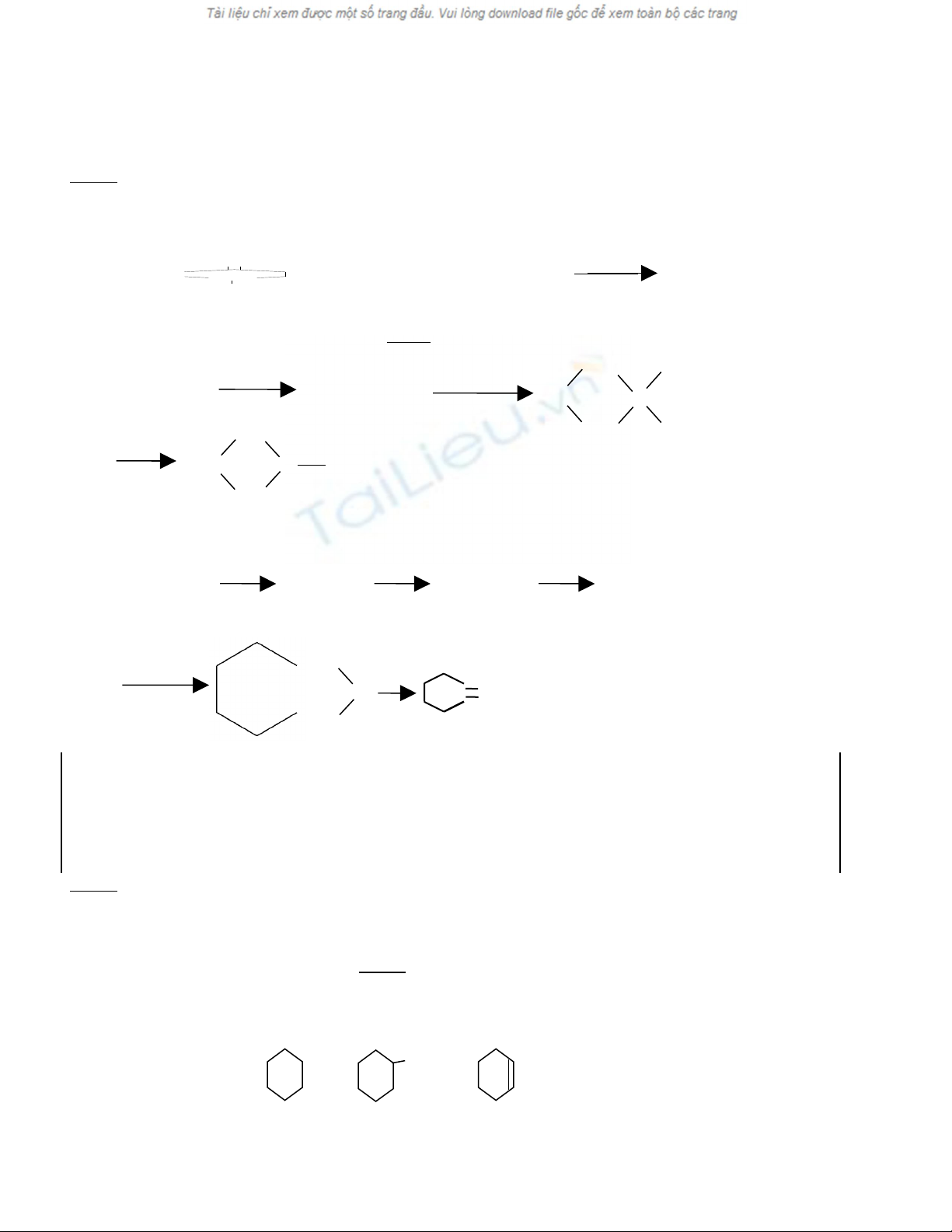
1) T các ch t ban đ u có s nguyên t cacbon ≤ 3, vi t các ph ng trình ph n ng (ghi rõ đi u ki nừ ấ ầ ố ử ế ươ ả ứ ề ệ
n u có) đi u ch : Axit xiclobutancacboxylic và Xiclopentanon .ế ề ế
2) T d n xu t halogen có th đi u ch đ c axit cacboxylic theo s đ sau :ừ ẫ ấ ể ề ế ượ ơ ồ
RX
CH
3
N
O
RMgX
→+).(
2khaneteCO
R-COOMgX
2
MgX
HX
−
+
R-COOH
D a theo s đ trên t metan hãy vi t ph ng trình ph n ng đi u chự ơ ồ ừ ế ươ ả ứ ề ế:Axit metyl malonic
GI IẢ
1.
2.
2CH4
→
ln)(1500 lC
o
C2H2 + 3H2
C2H2 + 2 HCl
→
CH3-CHCl2
CH3-CHCl2 + 2Mg
→
khanete.
CH3-CH(MgCl)2
CH3-CH(MgCl)2 + 2CO2
→
khanete.
CH3-CH(COOMgCl)2
CH3-CH(COOMgCl)2 + 2HCl
→
CH3-CH(COOH)2 + 2MgCl2
Câu 3 . Cho s¬ ®å ph¶n øng:
Ben zen
2
/H Pd
→
A
2
Cl
as
+
→
B
2
KOH
H O
+
−
→
C
4
0
KMnO
t
+
→
D (C6H10O4)
X¸c ®Þnh c«ng thøc cÊu t¹o cña A , B , C , D.
GI IẢ
S¬ ®å chuyÓn ho¸:
C6H6
2
/H Pd
→
C6H12
2
Cl
as
+
→
C6H11Cl
2
KOH
H O
+
−
→
C6H10
4
0
KMnO
t
+
→
HOOC-(CH2)4-COOH
(A) (B)
(C) (D)
C«ng thøc cÊu t¹o: Cl
HOOC-(CH2)4-COOH
+ CH2(COOH)2 CH2(COOC2H5)2
C2H5OH
+ BrCH2CH2Br Br(CH2)4Br NC(CH2)4CN HOOC(CH2)4COOH
Zn KCN H2O
Ca(OH)2
COO
COO
Ca to
O
Br(CH2)3Br
C2H5O-
COOC2H5
C
CH2
CH2
CH2
COOC2H5
CH
CH2
CH2
CH2
H3O+
- CO2
COOH

(A) (B) (C)
(D)
C©u 4
Hîp chÊt h÷u c¬ A chøa 79,59 % C; 12,25 % H; cßn l¹i lµ O chØ chiÕm
mét nguyªn tö trong ph©n tö. Ozon ph©n A thu ®îc HOCH2CH=O ;
CH3[CH2]2COCH3 vµ CH3CH2CO[CH2]2CH=0. NÕu cho A t¸c dông víi brom theo
tØ lÖ mol 1:1 råi míi ozon ph©n s¶n phÈm chÝnh sinh ra th× chØ thu ®-
îc hai s¶n phÈm h÷u c¬, trong sè ®ã cã mét xeton. §un nãng A víi dung
dÞch axit dÔ dµng thu ®îc s¶n phÈm B cã cïng c«ng thøc ph©n tö nh A,
song khi ozon ph©n B chØ cho mét s¶n phÈm h÷u c¬ duy nhÊt.
1. X¸c ®Þnh c«ng thøc cÊu t¹o vµ gäi tªn A.
2. T×m c«ng thøc cÊu t¹o cña B vµ viÕt c¬ chÕ ph¶n øng chuyÓn ho¸ A
thµnh B.
H íng dÉn gi¶i :
1.
: : = 13 :
24 : 1
A cã c«ng thøc ph©n tö C13H24O.
Tõ s¶n phÈm ozon ph©n t×m ra 2 c«ng thøc cÊu t¹o cã thÓ phï hîp:
CH3CH2CH2C=CH CH2CH2C=CHCH2OH CH3CH2CH2C = CCH2CH2CH=CHCH2OH
CH3 CH2CH3
H3C CH2CH3
(A1)
(A2)
Tõ ph¶n øng brom ho¸ råi ozon ph©n suy ra (A1) phï hîp, v×:
CH3CH2CH2C=CH CH2CH2C=CHCH2OH
(A1) CH3 CH2CH3
CH3CH2CH2CBrCHBrCH2CH2C=CHCH2OH xeton +
O=CHCH2OH
CH3 CH2CH3
CH3CH2CH2C = CCH2CH2CH=CHCH2OH
(A2) H3C CH2CH3
CH3CH2CH2CBrCBrCH2CH2CH=CHCH2OH an®ehit +
O=CHCH2OH
H3C CH2CH3
Tªn cña A: 3-Etyl-7-metyl®eca-2,6-®ien-1-ol
2. B ph¶i lµ hîp chÊt m¹ch vßng cã chøa 1 nèi ®«i trong vßng. B sinh
ra tõ A do ph¶n øng ®ãng vßng:
Br2
1 : 1
ozon ph©n
Br2
1 : 1
ozon ph©n
79,59
12
12,25
1
8,16
16
















![Bài tập trắc nghiệm Hóa đại cương [kèm đáp án chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250811/nganga_01/135x160/40711754905793.jpg)

![Đề cương ôn tập Hóa học đại cương [năm học] chuẩn nhất](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250722/hihihaha2/135x160/70581753206865.jpg)
![Đề thi giữa học kì 2 môn Hóa học lớp 10 (tham khảo) - [Kèm đáp án chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250319/vangiang1602/135x160/4131742402167.jpg)



![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)










![Phiếu bài tập cuối tuần Tiếng Việt 1 tuần 2 đề 2: [Hướng dẫn chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250728/thanhha01/135x160/42951755577464.jpg)

