
CAÂN BAÈNG PHÖÔNG TRÌNH PHAÛN ÖÙNG OXI HOÙA – KHÖÛ VÔÙI 6 BÖÔÙC
Bí kíp 6 böôùc :
Böôùc 1 : Xác định số oxi hóa của chất oxi hóa và chất khử (chất oxi hóa – khử).
Böôùc 2 : Xác định số e cho – nhận bằng qui tắc : lấy trị số của số oxi hóa sau tröø tröôùc nhân
với chỉ số của chất oxi hóa – khử ; thu được 2 con số ta tiến hành tối giản cặp số đó thu được
kết quả là 2 con số.
Böôùc 3 : Ta tìm bội số chung nhỏ nhất (BSCNN) của 2 con số thu được ở bước 2, lấy BSCNN
chia cho từng con số ta thu được tương ứng là hệ số của chất oxi hóa – khử (còn phải chỉnh sửa
hai con số này nên ta chỉ viết mờ vào phương trình để ghi nhớ!).
Böôùc 4 : Tiếp theo cân bằng số nguyên tử của nguyên tố là sản phẩm của sự oxi hóa – khử theo
hệ số của chất oxi hóa – khử đã thu được ở bước 3 (các hệ số này là hoàn toàn xác định và
không được chỉnh sửa gì thêm!).
Böôùc 5 : Tiếp tục đếm số nguyên tử của chất oxi hóa – khử mà không tham gia vào quá trình
oxi hóa – khử (chất tạo môi trường; nếu có), sau đó lấy con số này cộng với hệ số của chất oxi
hóa – khử thu được ở bước 3 ta thu được hệ số của chất oxi – khử (tới đây hệ số này là hoàn
toàn xác định và không được chỉnh sửa gì thêm).
Böôùc 6 : Bước cuối cùng là cân bằng số nguyên tử của các nguyên tố còn lại trong phương
trình phản ứng để được phương trình cân bằng.
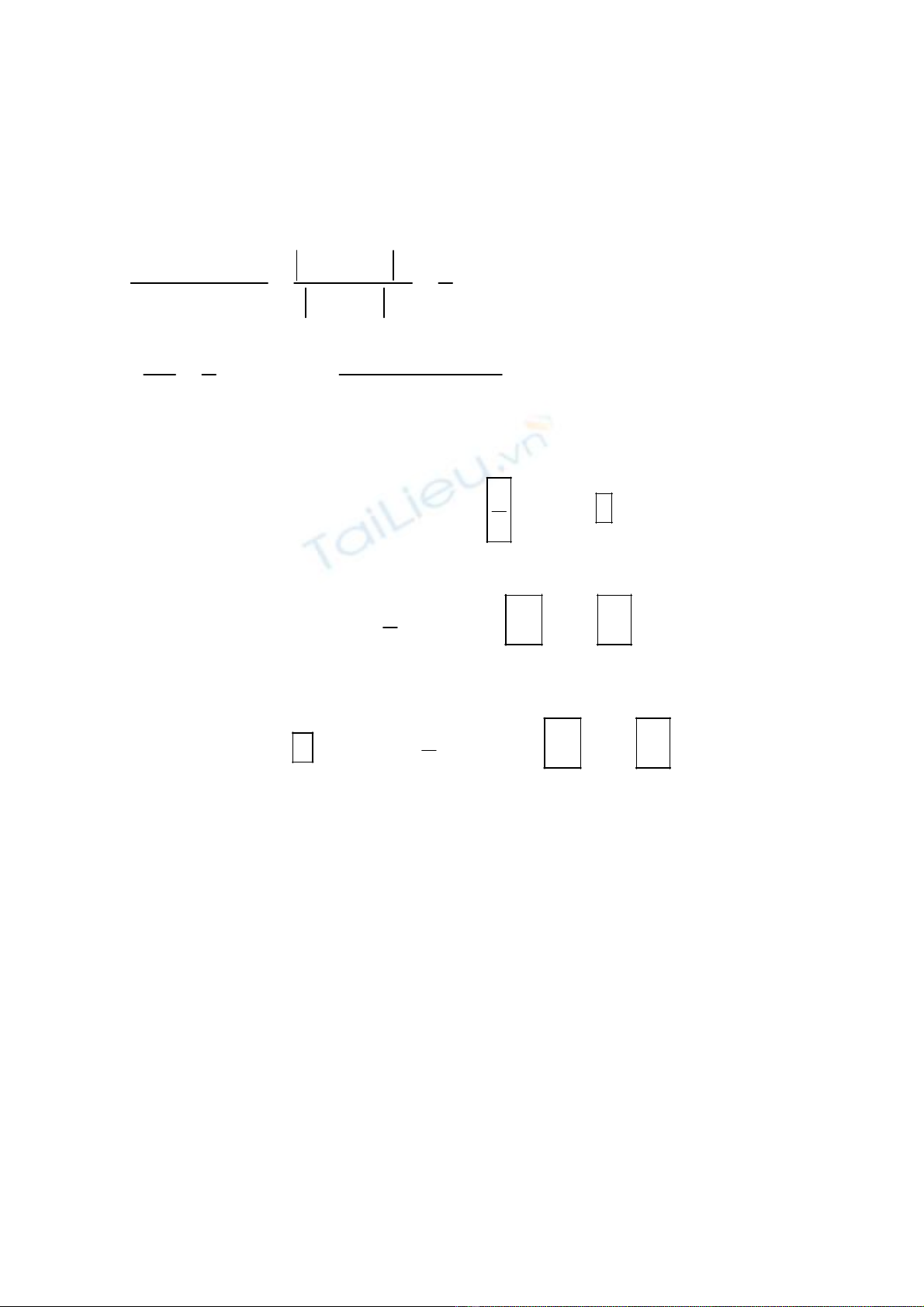
Minh hoïa :
Cân bằng phương trình phản ứng :
422
KMnO HCl Cl MnCl KCl H O
2
2
Thöïc hieän 6 böôùc :
Bước 1 :
7102
11
422
KMn O HCl Cl MnCl KCl H O
Bước 2 :
.().
().
.
e nhaän 1 271
5
011
e cho 1
1
Bước 3 :
..
77
11
7102
1
14 2 2 2
Mn 5 x 1 heä soá Mn
BSCNN=5
1
Cl x 5 heä soá Cl
1 KMn O 5 HCl Cl MnCl KCl H O
Bước 4 :
.. ..
7102
1
14 2 2 2
heä soá heä soá heä soá
chaát oxi hoùa chaát khöû sp khöû
heä soá
sp oxi hoùa
5
1 KMn O 5 HCl Cl 1 MnCl KCl H O
2
Bước 5 :
.. ...
..
.....
710211
1
14 2 2 1 2
1
1
710211
1
14 2 2 1 2
5
1 KMn O 5 HCl Cl 1 Mn Cl 1 K Cl H O
2
coù 1 2 1 1 3 Cl taïo moâi tröôøng coù 5 3 8 HCl
5
1KMn O 8 HCl Cl 1MnCl 1KCl H O
2
Bước 6 : ☺
422
2KMnO 16HCl 5Cl 2MnCl 2KCl 8H O
2








![Đề thi giữa học kỳ môn Hóa đại cương B có đáp án (Đề thi số 1121) [Kèm đáp án chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250812/namthangtinhlang_00/135x160/67881754992561.jpg)



![Bài tập trắc nghiệm Hóa đại cương [kèm đáp án chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250811/nganga_01/135x160/40711754905793.jpg)












![Bài tập so sánh hơn và so sánh nhất của tính từ [kèm đáp án/mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250808/nhatlinhluong27@gmail.com/135x160/77671754900604.jpg)
![Tài liệu tham khảo Tiếng Anh lớp 8 [mới nhất/hay nhất/chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250806/anhvan.knndl.htc@gmail.com/135x160/54311754535084.jpg)




![Tài liệu Lý thuyết và Bài tập Tiếng Anh lớp 6 [Mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250802/hoihoangdang@gmail.com/135x160/18041754292798.jpg)




