
Ngày nhận bài: 05-07-2024 / Ngày chấp nhận đăng bài: 25-11-2024 / Ngày đăng bài: 28-11-2024
*Tác giả liên hệ: Vũ Huỳnh Kim Long. Khoa Dược, Trường Đại học Tôn Đức Thắng, Thành phố Hồ Chí Minh, Việt Nam.
E-mail: vuhuynhkimlong@tdtu.edu.vn
© 2024 Bản quyền thuộc về Tạp chí Y học Thành phố Hồ Chí Minh.
https://www.tapchiyhoctphcm.vn 43
ISSN : 1859-1779
Nghiên cứu Dược học
Tạp chí Y học Thành phố Hồ Chí Minh - Dược học;27(5):43-52
https://doi.org/10.32895/hcjm.p.2024.05.06
Khảo sát thành phần hóa học và đánh giá tác dụng
kháng viêm của rễ tóc Sâm Việt Nam nuôi cấy mô
Nguyễn Ngọc Kim Ngân1, Hoàng Thị Thanh Trúc1, Phạm Ngọc Khánh Vân1,
Vũ Huỳnh Kim Long1,*
1Khoa Dược, Trường Đại học Tôn Đức Thắng, Thành phố Hồ Chí Minh, Việt Nam
Tóm tắt
Đặt vấn đề: Sâm Việt Nam - Panax vietnamensis, Araliaceae là loài dược liệu quý và đặc hữu của Việt Nam, có giá trị cao
và đối mặt nguy cơ tuyệt chủng. Sự phát triển của công nghệ sinh học giúp tạo ra lượng lớn sinh khối Sâm Việt Nam trong
thời gian ngắn. Mặc dù vậy, thành phần saponin cũng như tác dụng sinh học của rễ tóc Sâm Việt Nam nuôi cấy mô
(Vietnamese Ginseng hairy root – HVG) chưa được nghiên cứu nhiều.
Mục tiêu: Nghiên cứu thành phần saponin và tác dụng kháng viêm của HVG.
Đối tượng và phương pháp nghiên cứu: Bột HVG được chiết với ethanol để thu được cao toàn phần, sau đó chiết phân bố
với n-butanol bão hòa nước để thu được phân đoạn n-butanol (Bu). Cao Bu được tách phân đoạn bằng sắc ký cột silica gel
và tinh chế bằng HPLC điều chế. Các hợp chất được xác định cấu trúc bằng các phương pháp phổ nghiệm (MS, 1H và
13C-NMR). Tác dụng kháng viêm được xác định thông qua khả năng ức chế sản sinh NO của tế bào macrophage RAW 264.7.
Kết quả: Từ cao toàn phần HVG, quá trình chiết tách thu được hai hợp chất pseudoginsenosid F11 và vina-ginsenosid R1.
Cao toàn phần HVG và hợp chất vina-ginsenosid R1 cho thấy hoạt tính kháng viêm với giá trị IC50 lần lượt là 71,07±2,7 và
79,59±5,10 µg/mL cao hơn khoảng 6,5 lần so với IC50 của chứng dương dexamethason là 12,64±1,28 µg/mL.
Kết luận: Từ HVG phân lập được hai saponin khung ocotillol là pseudoginsenosid F11 và vina-ginsenosid R1. Cao toàn phần
và hợp chất vina-ginsenosid R1 thể hiện tác dụng kháng viêm và có tiềm năng sử dụng bên cạnh Sâm Việt Nam trồng.
Từ khóa: Rễ tóc Sâm Việt Nam, saponin, vina-ginsenosid R1, kháng viêm
Abstract
STUDY ON CHEMICAL CONSTITUENT AND ANTI-INFLAMMATORY
EFFECT OF HAIRY ROOT CULTIVATED FROM CALLUS
PANAX VIETNAMENSIS
Nguyen Ngoc Kim Ngan, Hoang Thi Thanh Truc, Pham Ngoc Khanh Van, Vu Huynh Kim Long

Tạp chí Y học Thành phố Hồ Chí Minh - Dược học * Tập 27 * Số 5* 2024
44 | https://www.tapchiyhoctphcm.vn https://doi.org/10.32895/hcjm.p.2024.05.06
Introduction: Vietnamese ginseng (Panax vietnamensis, Araliaceae) is a precious and endemic medicinal herb with
high economic value and is currently endangered. Advances in biotechnology facilitate the production of a large amount
of Vietnamese Ginseng biomass in a short period. However, the chemical composition and bioactivity of hairy root from
cultured callus Vietnamese Ginseng (HVG) have not been extensively studied.
Objective: Isolation of saponins from HVG and in vitro evaluation of the anti-inflammatory effect of ethanol extract and
isolated saponin.
Methods: HVG powder was extracted with ethanol to obtain the total extract. The n-butanol fraction (Bu) was obtained
by partitioning the total extract with water-saturated n-butanol. The Bu fraction was fractionated using silica gel column
chromatography and subsequently purified by preparative HPLC. The compounds were identified by MS, 1H, and
13C-NMR spectroscopy. The anti-inflammatory activity was determined through their ability to inhibit the NO production
by RAW 264.7 macrophage cells.
Results: From the total HVG extract, two compounds were isolated and identified as pseudoginsenoside F11 and
vina-ginsenoside R1 by spectrometric methods. The HVG ethanol extract and vina-ginsenoside R1 showed
anti-inflammatory activity with IC50 values of 71.07±2.7 and 79.59±5.10 µg/mL, respectively, which was about 6.5 times
higher than that of dexamethasone used as positive control, which was 12.64±1.28 µg/mL.
Conclusion: Vietnamese Ginseng hairy root contains characteristic components pseudoginsenoside F11 and
vina-ginsenoside R1. The total extract and vina-ginsenoside R1 compound demonstrated potential anti-inflammatory
effect, which could be an alternative source of therapeutic reagent for natural cultured Vietnamese Ginseng.
Keywords: hairy root Vietnamese Ginseng; saponin; vina-ginsenoside R1; anti-inflammatory
1. ĐẶT VẤN ĐỀ
Sâm Việt Nam (SVN) được phát hiện năm 1973 tại
vùng núi Ngọc Linh với tên khoa học Panax vietnamensis
thuộc họ Araliaceae. Đây là dược liệu quý, đặc hữu của
Việt Nam và có giá trị kinh tế cao. Thành phần hóa học
chính của SVN là các ginsenosid khung protopanaxatriol
(ginsenosid Rg1, notoginsenosid R1…), protopanaxadiol
(G-Rb1, G-Rd…) và đặc biệt là các saponin khung
ocotillol như majonosid R2 (M-R2) và vina-ginsenosid
R2 (V-R2) với hàm lượng rất cao làm nên sự khác biệt
cho SVN với các loài Panax khác [1]. Nhiều tác dụng
dược lý của SVN và M-R2 đã được chứng minh như
chống ung thư, chống trầm cảm, kháng viêm [2-4]... Do
đó, việc sử dụng và khai thác sâm Việt Nam quá mức làm
cho loài sâm này cạn kiệt trong tự nhiên và nguồn trồng
trọt không đáp ứng đủ cho nhu cầu thị trường. Điều này
khiến cho giá thành của dược liệu này hiện đang rất cao
và là rào cản cho đa số người tiêu dùng có thể tiếp cận sử
dụng. Ngày nay, với sự phát triển của công nghệ nuôi cấy
mô sẹo, SVN được nuôi trong môi trường in vitro nhằm
tạo ra sinh khối trong thời gian ngắn. Điều này hứa hẹn sẽ
là nguồn cung sinh khối rễ tóc SVN nuôi cấy mô
(Vietnamese Ginseng hairy root - HVG) với giá thành
hợp lý, đáp ứng nhu cầu của đại đa số người tiêu dùng.
Các nghiên cứu bước đầu khảo sát thành phần hoá học
của HVG bằng phương pháp khối phổ (Mass
Spectrometry - MS) bước đầu cho thấy HVG cũng chứa
các saponin khung ocotillol [5]. Tuy nhiên, chưa có
nghiên cứu phân lập và xác định cấu trúc của các
saponin này cũng như đánh giá tác dụng kháng viêm
của HVG vẫn chưa được đánh giá. Trong nghiên cứu
này, từ sinh khối HVG, chúng tôi đã phân lập được
hai hợp chất saponin khung ocotillol từ HVG là vina-
ginsenosid R1 (V-R1) và pseudo-ginsenosid F11 (p-F11).
Đồng thời, nghiên cứu cũng cho thấy cao chiết toàn
phần HVG và hợp chất V-R1 có tác dụng kháng viêm
tiềm năng.
2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP
NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
Rễ SVN nuôi cấy mô tươi (n=10, 3 kg) được Trung tâm
Công nghệ sinh học TP. Hồ Chí Minh (2374 QL1A, Khu phố

Tạp chí Y học Thành phố Hồ Chí Minh - Dược học * Tập 27 * Số 5 * 2024
https://doi.org/10.32895/hcjm.p.2024.05.06 https://www.tapchiyhoctphcm.vn | 45
2, Quận 12, Thành phố Hồ Chí Minh) cung cấp. Rễ được
nuôi cấy trong 90 ngày theo quy trình đã được công bố bởi
Hà Thị Loan và cộng sự [5]. Rễ tươi được sấy ở nhiệt độ
dưới 50 ºC thu được 312 g rễ khô có độ ẩm dưới 13%. Các
mẫu được xay riêng biệt thành bột thô để dùng cho chiết xuất.
Một phần bột thô của mỗi mẫu được tiếp tục xay thành bột
mịn để dùng cho phân tích HPLC-ESI-MS. Thân rễ và rễ củ
SVN trồng (n=10) được cung cấp bởi Công ty Cổ phần Sâm
Ngọc Linh Tu Mơ Rông, Kon Tum. Rễ được sấy ở nhiệt độ
dưới 60 ℃ và xay thành bột mịn.
2.2. Hóa chất và thiết bị
Sắc ký lớp mỏng (SKLM) dùng bản mỏng silica gel 60
F254 tráng sẵn trên nền nhôm (Merck, Đức). Sắc ký cột
(SKC) có pha tĩnh là silica gel 40-60 µm được cung cấp bởi
Merck (Đức). Các dung môi và hóa chất sử dụng trong phân
lập như chloroform, methanol, ethanol n-butanol… được
cung cấp bởi công ty Chemsol (Việt Nam), acid sulfuric
được cung cấp bởi Xilong (Trung Quốc). Acetonitril và
methanol đạt tiêu chuẩn sắc ký được cung cấp bởi J. T. Baker
(Mỹ), acid formic đạt tiêu chuẩn sắc ký được cung cấp bởi
Merck (Đức). Nước cất hai lần thu được từ hệ thống cất nước
hai lần Aquatron 4000 (Stuart, Anh). Lipopolysaccharid (LPS)
chiết xuất từ Escherichia coli được cung cấp bởi Sigma
Chemical Co. (St. Louis, MO, USA). Môi trường Dulbecco’s
Modified Eagle’s Medium (DMEM) và huyết thanh nhau thai
bê (FBS) được cung cấp bởi Life Technologies, Inc.,
(Gaithersburg, MD, USA). Natri nitrit, sulfanilamid,
N-1-napthylethylenediamin dihydrochlorid và dimethyl
sulfoxid (DMSO) của hãng Sigma Chemical Co. (St. Louis,
MO, USA). Hệ thống sắc ký lỏng điều chế Shimadzu LC-8A
sử dụng cột sắc ký Supelco C18 (250×21 mm, 10 µm). Phân
tích định tính được thực hiện trên hệ thống HPLC Agilent
1260 Infinity với đầu dò MSD Single Quadrupole G6125B sử
dụng cột Phenomenex Kinetex C18 (50×4,6 mm, 2,7 µm).
Phổ HR-MS được ghi trên hệ thống LC-QTOF-MS SCIEX
X500R QTOF. Phổ 1H-NMR và phổ 13C-NMR được ghi trên
hệ thống Bruker AvanceNEO 600 MHz.
2.3. Phương pháp nghiên cứu
2.3.1. Phân tích thành phần hóa học bằng
HPLC-ESI-MS
Bột HVG hoặc SVN trồng (100 mg) được chiết bằng siêu
âm với 10 ml methanol 70% trong 40 phút. Dịch chiết được
lọc qua màng lọc 0,22 µm và phân tích bằng HPLC-ESI-MS
sử dụng cột Phenomenex Kinetex (50×4,6 mm, 2,7 µm) với
pha động gồm acetonitril (A) và nước (B) chứa 0,1%
acid formic ở cả hai kênh với chương trình rửa giải gradient:
0-10 phút: 22% A; 10-15 phút: 22-30% A; 15-25
phút: 30-40% A; 25-35 phút: 40-60% A; 40-45 phút:
60-95% A; 45-46 phút: 95-22% A; 46-55 phút: 22% A. Tốc
độ dòng được cài đặt ở 0,6 ml/phút với thể tích tiêm
mẫu 10 µl. Đầu dò MS được cài đặt ở chế độ quét ion âm ở
khoảng 100-1500 Da với điện thế mao quản: 3,5 kV, áp suất
hóa hơi: 45 psi, lưu lượng khí làm khô: 5 l/phút, nhiệt độ khí
làm khô: 300 °C, điện áp vòi phun: 500 V, điện thế phân
mảnh: 150 V. Các hợp chất được xác định sơ bộ bằng các so
sánh m/z của phân mảnh giả ion [M+Cl]- và so sánh với dữ
liệu khối lượng phân tử của các saponin đã biết.
Chiết xuất
Bột HVG (300 g) được chiết bằng Soxhlet với 1.500 ml
ethanol 96% trong thời gian 12 giờ. Dịch chiết ethanol được
cô quay dưới áp suất giảm để thu được cao đặc. Cao toàn
phần sau đó được chiết phân bố lỏng-lỏng bảy lần, mỗi lần
600 ml n-butanol bão hòa nước, cô dưới áp suất giảm để thu
cao n-butanol (Bu).
Phân lập các saponin từ cao n-butanol
Cao n-butanol được phân tách bằng sắc ký cột silica gel
với pha động CHCl3 - MeOH - H2O với tỷ lệ thay đổi dần từ
10:1:0,2 đến 3:1:0,2. Các phân đoạn được theo dõi bằng
SKLM thu được 18 phân đoạn 1-18. Các phân đoạn này
được phân tích bằng HPLC-ESI-MS với điều kiện tương tự
điều kiện sử dụng để phân tích thành phần hóa học với pha
động gồm acetonitril (A) và nước (B) chứa 0,1% acid formic
ở cả hai kênh rửa giải gradient theo chương trình: 0-20 phút:
24-95% A, 20-25 phút: 95% A, 25-26 phút: 95-24% A, 26-32
phút: 24% A. Phân đoạn có khối lượng nhiều và sắc
ký đồ đơn giản được chọn để tinh chế thu được saponin
tinh khiết.
Tinh khiết hoá các saponin bằng HPLC điều chế
Các phân đoạn tiềm năng được phân tách bằng HPLC điều
chế sử dụng Hệ thống HPLC Shimadzu LC-8A với cột
Supelco C18 25×21,2 cm; 10 µm. Pha động sử dụng là hỗn
hợp acetonitril và nước với tỷ lệ phù hợp ở tốc độ dòng
20 ml/phút. Các đỉnh được phát hiện ở bước sóng 190 nm.
Thể tích tiêm mẫu 5 ml.
Tạp chí Y học Thành phố Hồ Chí Minh - Dược học * Tập 27 * Số 5* 2024
46 | https://www.tapchiyhoctphcm.vn https://doi.org/10.32895/hcjm.p.2024.05.06
Xác định cấu trúc các hợp chất thu được
Cấu trúc các chất phân lập được xác định bằng dữ liệu phổ
ESI-MS, 1H-NMR và 13C-NMR và so sánh với tài liệu đã
công bố.
Đánh giá tác dụng kháng viêm
Quy trình được thực hiện theo phương pháp của Liao H và
cộng sự [6] tại Phòng Thử nghiệm sinh học, Viện Công nghệ
Sinh học trực thuộc Viện Hàn lâm Khoa học và Công nghệ
Việt Nam. Cụ thể, tế bào RAW 264.7 được nuôi môi trường
DMEM được bổ sung 10 % FBS, 2 mM L-glutamin, HEPES
10 mM, và natri pyruvat 1,0 mM. Sau khi đạt mật độ 70-80 %,
tế bào được chuyển vào đĩa 96 giếng với mật độ 2×105 tế bào
cho mỗi giếng và ủ ở nhiệt độ 37 oC trong môi trường chứa
5 % CO2 trong 24 giờ. Thay môi trường DMEM không có
FBS để tế bào tiếp xúc trong 3 h và sau đó được ủ với mẫu thử
(0,8-100 µg/ml) hoặc chứng dương dexamethasone (0,8-100
µg/ml) trong 2 giờ. Các giếng chỉ ủ với môi trường được coi
là đối chứng âm. Tế bào sau đó được kích thích sản sinh NO
bằng LPS trong 24 giờ ở nồng độ 10 μg/mL. Sau đó môi
trường ủ mẫu (100 µl) được chuyển sang đĩa 96 giếng khác và
thêm vào thuốc thử Griess (100 µl) chứa 1% sulfanilamid
trong acid phosphoric 5% và N-1-naphthylethylenediamin
dihydrochlorid pha trong nước (50 μl). Hỗn hợp phản ứng
được ủ ở nhiệt độ phòng trong thời gian 10 phút và đo ở bước
trong 540 nm trên máy đọc đĩa 96 giếng. Mẫu trắng là môi
trường DMEM không FBS. Nồng độ nitrit của từng giếng
được tính toán dựa vào đường tuyến tính của chuẩn natri nitrit
và so sánh với mẫu chứng âm. Hoạt tính ức chế sinh NO được
tính toán dựa theo công thức (1). Nồng độ ức chế 50% sự hình
thành NO (IC50) được xác định bằng phương trình hồi quy
tuyến tính tương quan giữa nồng độ và tỷ lệ ức chế sử dụng
phần mềm TableCurve 2Dv4.
% ức chế= 100- Hàm lượng NOmẫu thử
Hàm lượng NOmẫu trắng ×100 (1)
Mức độ sống của tế bào RAW được đánh giá bằng phương
pháp MTT. Cụ thể, đĩa nuôi cấy tế bào sau khi thu dịch nổi,
mỗi giếng được thêm 90 µl môi trường nuôi tế bào và 10 µl
dung dịch MTT pha trong đệm DPBS (5 mg/ml). Sau khi ủ 4
giờ, môi trường được loại bỏ và tinh thể formazan được hoà
tan bằng 50 µL DMSO và mật độ quang (OD) được đo ở bước
sóng 540 nm bằng máy ELISA BioTek Elx800. Tỷ lệ tế bào
sống được xác định bằng công thức (2).
% tế bào sống = ẫ -
- ×100 (2)
3. KẾT QUẢ
3.1. Khảo sát thành phần hóa học rễ tóc Sâm Việt
Nam nuôi cấy mô so sánh với Sâm Việt Nam trồng
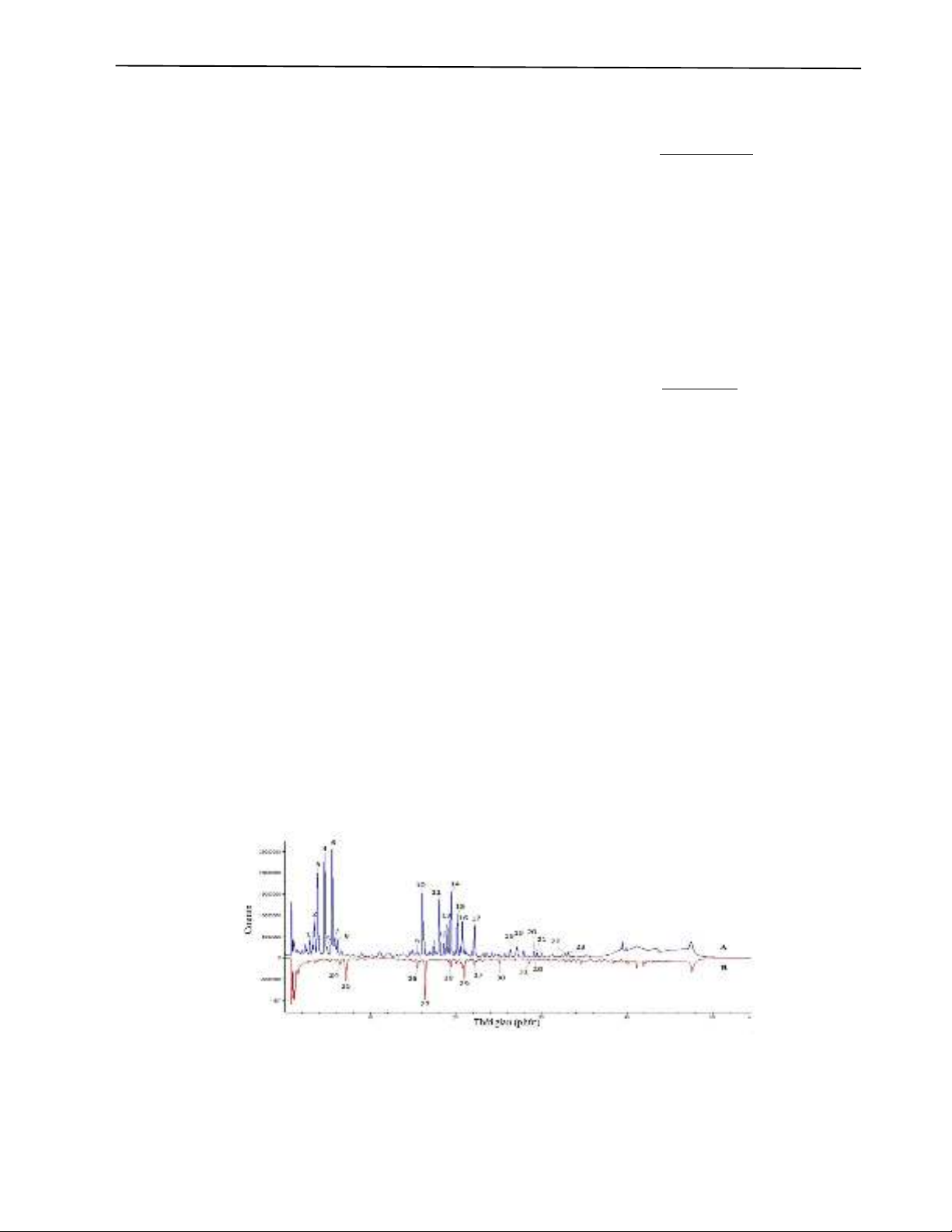
Sắc ký đồ HPLC-ESI-MS đại diện của các mẫu SVN
trồng và HVG được trình bày tại Hình 1. Các đỉnh chính của
các mẫu được xác định và liệt kê tại Bảng 1. Kết quả cho
thấy dịch chiết của HVG không phát hiện các saponin đặc
trưng của SVN trồng như ginsenoside Rg1, Re, Rb1, Rh1, Rc
nhưng lại có các peak chính của các hợp chất
pseudoginsenoside F11 (Rt 7,2 phút) và vina-ginsenosid R1
(Rt 16,4 phút). Đây là các saponin khung ocotillol vốn chiếm
hàm lượng rất thấp trong SVN trồng. Điều này cho thấy
HVG được nuôi cấy trong môi trường nhân tạo có quá trình
sinh tổng hợp khác biệt với SVN sinh trưởng trong môi
trường tự nhiên.
Hình 1. Sắc ký đồ HPLC-ESI-MS của Sâm Việt Nam trồng (A) và rễ tóc Sâm Việt Nam nuôi cấy mô (B)
1: Vinaginsenosid R24; 2: Notoginsenosid R1; 3: Majonosid-R1; 4: Ginsenosid Rg1; 5: Ginsenosid Re; 6: Majonosid R2; 7: Vinaginsenosid R11; 8:
Pseudoginsenosid RT4; 9: chưa xác định; 10: Vinaginsenosid R2; 11: Chikusetsusaponin L8; 12: chưa xác định; 13: Ginsenosid Rh1; 14: Ginsenosid Rb1;
15: Notoginsenosid Fc; 16: Ginsenosid Rc; 17: Ginsenosid Rd; 18-24: chưa xác định; 25: Pseudoginsenosid F11; 26: chưa xác định; 27: Vinaginsenosid
R1; 28: chưa xác định; 29: chưa xác định; 30: Ginsenosid IX; 30: Chikusetsusaponin IV; 31: Pseudoginsenoside RT1
Tạp chí Y học Thành phố Hồ Chí Minh - Dược học * Tập 27 * Số 5 * 2024
https://doi.org/10.32895/hcjm.p.2024.05.06 https://www.tapchiyhoctphcm.vn | 47
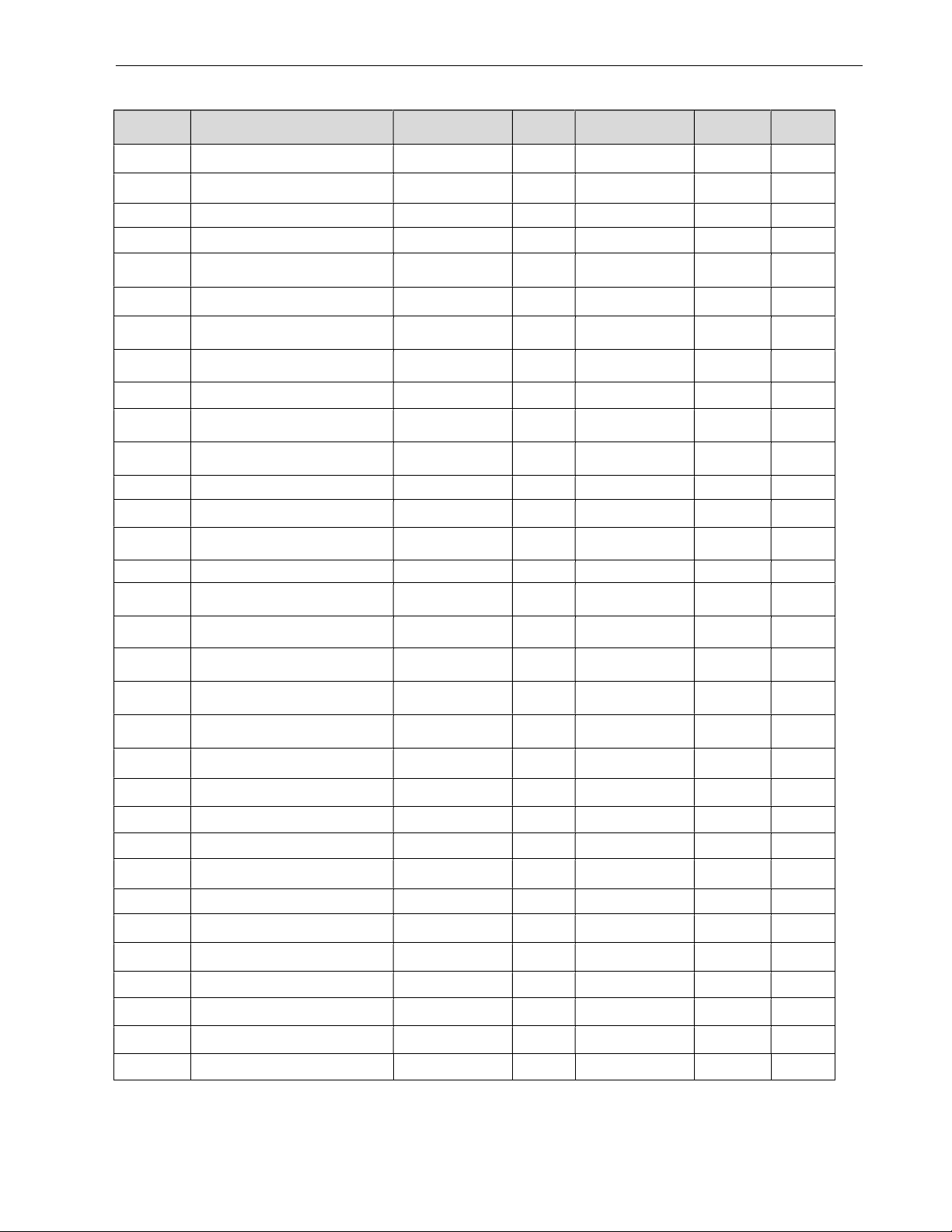
Bảng 1. Thành phần saponin của Sâm Việt Nam nuôi cấy mô so sánh với Sâm Việt Nam trồng phát hiện bằng HPLC-ESI-MS
Rt (phút) Tên hợp chất m/z [M+Cl]- M Công thức phân tử
Rễ tóc SVN
SVN trồng
2,9 Vinaginsenosid R24 998,0 962,5 C48H82O19 o ×
3,4 Notoginsenosid R1 968,0 932,5 C47H80O18 o ×
3,8 Majonosid R1 852,5 817,0 C42H72O15 o ×
4,7 Ginsenosid Rg1 836,0 800,5 C42H72O14 o ×
4,9 Ginsenosid Re 982,1 946,6 C48H82O18 o ×
5,5 Majonosid R2 822,5 787,0 C41H70O14 o ×
5,8 Vinaginsenosid R11 822,0 786,5 C41H70O14 o ×
6,1 Pseudoginsenosid RT4 35,5 654,4 C36H62O10 o ×
6,5 Chưa xác định 35,5 800,5 C42H72O14 × o
7,2 Pseudoginsenosid F11 835,5 800,0 C42H72O14 × o
15,5 Chưa xác định 864,0 828,5 C43H72O15 o ×
15,5 Vinaginsenosid R2 864,0 828,5 C43H72O15 o ×
16,1 Chưa xác định 878,0 842,5 C44H74O15 o ×
16,4 Vinaginsenosid R1 878,0 842,5 C44H74O15 × o
18,1 Chikusetsusaponin L8 806,0 770,5 C41H70O13 o ×
18,6 Chưa xác định 655,9 620,4 C36H60O8 o ×
19,0 Ginsenosid Rh1 674,4 638,9 C36H62O9 o ×
19,4 Chưa xác định 1144,1 1108,6 C54H92O23 × o
19,5 Ginsenosid Rb1 1144,1 1108,6 C54H92O23 o ×
20,2 Notoginsenosid Fc 1246,1 1210,6 C58H98O26 o ×
20,8 Ginsenosid Rc 1114,1 1078,6 C52H90O22 o ×
21,0 Chưa xác định 1114,1 1078,6 C52H90O22 × o
22,2 Ginsenosid Rd 982,1 946,6 C48H82O18 × ×
25,1 Ginsenosid IX 952,0 916,5 C47 H80 O17 × o
26,4 Chưa xác định 655,9 620,4 C36H60O8 o ×
27,1 Chưa xác định 655,9 620,4 C36H60O8 o ×
28,6 Chikusetsusaponin IV 961,0 926,5 C47H74O18 × o
28,6 Pseudoginsenoside RT1 961,0 926,5 C47H74O18 × o
29,2 Chưa xác định 784,5 820,0 C42H72O13 × ×
29,5 Chưa xác định 784,5 820,0 C42H72O13 o ×
32,8 Chưa xác định 802,0 766,5 C42H70O12 o ×
33,2 Chưa xác định 802,0 766,5 C42H70O12 o ×
Chú thích: ×: Có phát hiện trong mẫu; o: Không phát hiện trong mẫu













![Bài tập Đa dạng thế giới sống [kèm đáp án/ hướng dẫn giải]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251123/thaohoang9203@gmail.com/135x160/5861763951302.jpg)











![Câu hỏi trắc nghiệm Tế bào nhân sơ [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251104/xuangiao2601/135x160/40491762309854.jpg)
