NGHIÊN CỨU KHẢO SÁT SỰ SINH TRƯỞNG VÀ PHÁT TRIỂN TẠO SINH KHỐI CỦA
CHỦNG SACCHAROMYCES CEREVISIAE GIỮA HAI PHƯƠNG PHÁP LÊN MEN BATCH
VÀ FED- BATCH
TÓM TẮT
Nghiên cứu khảo sát sự sinh trưởng và phát triển của chủng Saccharomyces cerevisiae trong các
điều kiện lên men batch và fed- batch với môi trường YPD cho thấy việc bổ sung thêm cơ chất
( dịch Glucose) tại nhiều thời điểm hơn trong điều kiện nuôi cấy Fed-Batch cho kết quả nấm sinh
trưởng tốt hơn và chiều dài pha sinh trưởng kéo dài hơn so với lên men Batch. Khối lượng tế bào
nấm men phụ thuộc đáng kể vào nồng độ các thành phần môi trường, các nguồn C, N, P, muối
khoáng và các yếu tố lí hóa (pH, thời gian lên men). Kết quả nghiên cứu này có thể làm tiền đề
cho các ứng dụng lên men công nghiệp khác nhau trong thực tế.
Từ khóa: Saccharomyces cerevisiae, YPD, Fed, Fed- Batch, Glucose.
I.MỞ ĐẦU
Saccharomyces cerevisiae là loài nấm men
thuộc lớp Ascomycetes, được ứng dụng rộng
rãi trong nhiều lĩnh vực công nghiệp như
thực phẩm, dược phẩm và sản xuất nhiên
liệu sinh học nhờ khả năng lên men hiệu quả
và dễ dàng thao tác di truyền. Đây là sinh
vật nhân thực đơn bào đầu tiên có bộ gen
được giải mã hoàn chỉnh, trở thành mô hình
kinh điển trong nghiên cứu sinh học phân tử
và công nghệ sinh học hiện đại (Goffeau et
al., 1996). Khả năng sinh trưởng mạnh mẽ
trong điều kiện hiếu khí và yếm khí, cùng
với năng lực chuyển hóa các loại đường
thành ethanol và CO₂ đã giúp S. cerevisiae
trở thành lựa chọn phổ biến trong sản xuất
ethanol, protein tái tổ hợp và các sản phẩm
có giá trị sinh học cao (Nevoigt, 2008).
Trong quy trình nuôi cấy vi sinh vật, hiệu
suất sản xuất phụ thuộc nhiều vào điều kiện
nuôi cấy và mô hình lên men được sử dụng.
Lên men Batch (gián đoạn) là phương pháp
truyền thống, trong đó toàn bộ chất nền
được thêm vào ngay từ đầu quá trình nuôi
cấy. Tuy nhiên, phương pháp này thường
dẫn đến hiện tượng tích tụ chất độc, thay đổi
nhanh chóng về điều kiện môi trường và làm
giảm tốc độ sinh trưởng ở giai đoạn sau
(Shuler & Kargi, 2017). Ngược lại, quá trình
lên men Fed-Batch (bán liên tục) cho phép
bổ sung chất nền theo thời gian, giúp kiểm
soát tốc độ sinh trưởng của tế bào, hạn chế
ức chế do nồng độ cơ chất cao và nâng cao
hiệu suất sản phẩm (Stanbury et al., 2016).
Đánh giá sự sinh trưởng và phát triển của S.
cerevisiae trong hai mô hình lên men batch
và Fed-Batch không chỉ giúp hiểu rõ hơn về
đặc điểm sinh lý của nấm men trong từng
điều kiện nuôi cấy, mà còn cung cấp cơ sở
khoa học để tối ưu hóa quy trình sản xuất
sinh khối hoặc sản phẩm mục tiêu. Nghiên
cứu này hướng đến việc so sánh hai phương
pháp lên men nhằm xác định mô hình phù
hợp cho việc nuôi cấy S. cerevisiae hiệu quả
trong điều kiện phòng thí nghiệm, làm cơ sở
cho các ứng dụng quy mô lớn trong tương
lai.
II.VẬT LIỆU VÀ PHƯƠNG PHÁP
2.1.Vật liệu
Giống vi sinh vật:
Nghiên cứu này sử dụng chủng nấm men
Saccharomyces Cerevisiae (nấm men bánh
mì) được bảo quản trên môi trường YPD
agar ở 4°C.

Môi trường dinh dưỡng:
Sử dụng môi trường YPD
- Môi trường hoạt hóa gồm có: cao nấm men
0.5g , pepton 0.5g, Glucose 1g.
- Môi trường nhân giống gồm có: cao nấm
men 1g, pepton 1g, KH2PO4 0.5g,
MgSO4.7H2O 0.01g.
- Môi trường lên men:
Dịch lên men Batch và Fed-Batch có những
thành phần chung sau: glucose: 200 g/l,
peptone: 10 g/l, cao nấm men: 10 g/l.
+ Lên men Batch sử dụng 200g/l Glucozo để
bổ sung ngay từ ban đầu.
+ Lên men Fed- Batch sử dụng dịch cấp
glucose (180g/l) riêng, bổ sung từng đợt
vào hệ thống lên men trong suốt quá trình.
2.2. Phương pháp
2.2.1. Phương pháp nghiên cứu
2.2.1.1. Hoạt hóa
Nấm men khô thương mại được hoạt hóa
bằng cách rắc 6-7 hạt vào bình tam giác
100ml có chứa sẵn 25ml môi trường YPD,
đem nuôi lắc ở 25°C trong 24h.
2.2.1.2. Nhân giống
Sau khi hoạt hóa, chuyển dịch hoạt hóa
với tỷ lệ tiếp giống 5% (5ml) sang bình tam
giác… 250mL chứa 100mL môi trường YPD;
tiến hành nhân giống trong 18h ở tủ nuôi lắc
25°C.
2.2.1.3. Lên men
Sử dụng thiết bị lên men dung tích 2L
* Lên men Batch
Thể tích dịch lên men 1L cho vào thiết bị
lên men, ở điều kiện nhiệt độ 30 ± 0.5°C,
tốc độ khuấy 600 rpm, sục khí mức LOW cứ
5 phút một lần mỗi lần sục 2 phút.
* Lên men Fed- Batch
Sử dụng phương pháp cấp dưỡng theo
hàm số mũ để kéo dài pha log.
Dung dịch glucose được bổ sung bắt đầu
từ giờ thứ 7 kể từ khi lên men.
- Tốc độ cấp dưỡng Ft được tính toán theo
công thức: Ft = Fo x eu.t
Với Fo là tốc độ cấp dưỡng ban đầu, được
tính theo công thức:
Fo = ( u.Xo.Vo )/Yx/s
Trong đó:
…+ X0 là lượng sinh khối tại thời điểm bắt đầu
cấp dưỡng (g)
…+…u …là tốc độ sinh trưởng trong giai đoạn
batch
…+ t là thời gian tính từ lúc bắt đầu cấp
dưỡng (h)
…+ Yx/s là hệ số tạo thành sinh khối từ cơ
chất (g/g)
…
*Lấy mẫu và phân tích:
Trong quá trình lên men, tiến hành lấy
mẫu đều đặn với thời gian khoảng 1giờ/lần.
Các thông số phân tích bao gồm: mật độ tế
bào, độ hấp thụ ở bước sóng 600nm
(OD600), đường khử, sinh khối ướt, sinh
khối khô, lượng cồn.
2.2.2. Phương pháp phân tích
2.2.2.1. Xác định mật độ tế bào
Bằng cách sử dụng buồng đếm hồng cầu
loại Neubauer, mẫu được pha loãng ở mức
thích hợp, đem đi vortex và được soi dưới
kính hiển vi, vật kính 40X để đếm, đếm 5 ô:
4 ô góc và 1 ô trung tâm, nếu số lượng tế
bào trong 1 ô nằm ngoài khoảng 25-250 tế
bào thì cần pha loãng lại. Sau đó, tính mật
độ tế bào có trong canh trường theo công
thức như sau:
(a x Df x 1000)/ S x h
Trong đó:
a: số tế bào trung bình có trong 1 ô
Df: hệ số pha loãng
h: độ sâu lưới đếm
S: Diện tích của ô tương ứng với số lượng tế
bào đếm được
1000: hệ số chuyển đổi 1ml= 1000
m m3
2.2.2.2. Đo mật độ quang học (OD 600nm)
Nhằm theo dõi sự phát triển của nấm men
theo thời gian.
Canh trường nuôi cấy được hút vào ống
eppendorf 2 mL, đem vortex kĩ. Sau đó, đổ
dịch vào trong cuvette và đặt vào máy đo
OD tại bước sóng 600nm. Mẫu kiểm chứng
là 1 mL nước cất. Nếu giá trị OD lớn hơn 1,
pha loãng lại. Ghi lại giá trị OD600 hiển thị

trên màn hình.
2.2.2.3. Xác định tốc độ sinh trưởng
Sau khi đo OD, có số liệu ta tính được tốc
độ sinh trưởng u nhờ Excel nhờ công thức
sau:
X = Xi x e^(ut)
lnX = lnXi x ut
Trong đó:
u - tốc độ sinh trưởng đo được, [h-1];
X, Xi – lượng sinh khối tạo thành tại thời
điểm t và ban đầu, [kg.m-3];
t - là thời gian, [h]
2.2.2.4. Xác định đường khử
Sử dụng phương pháp DNS.
Dịch canh trường mỗi lần lấy sẽ được ly
tâm với tốc độ 6000 vòng/phút trong 5
phút.Tiếp theo, lấy 0.3 ml dịch nổi cùng với
0.6 ml dung dịch DNS vào ống eppendorf
đem đi vortex. Hỗn hợp đó được đun sôi
cách thủy trong 5 phút và sau đó được làm
lạnh nhanh tới nhiệt độ phòng và đo độ hấp
thụ ở bước sóng 540 nm. Sau đó thay vào
phương trình đường chuẩn để tính toán.
Glucose được sử dụng làm chất chuẩn để
xây dựng đường chuẩn bằng cách cân chính
xác 0,01g glucozo pha loãng với 10mL nước
cất để được dung dịch chất chuẩn có nồng
độ 1g/L.
2.2.2.5. Xác định sinh khối ướt và khô
Trước tiên, cân khối lượng của ống
eppendorf 2ml, tiếp đó hút 1ml dịch canh
trường vào ống đó, đem ly tâm với tốc độ
6000 vòng/phút trong 5 phút để tách sinh
khối và dịch nổi. Sau đó loại bỏ phần dịch
nổi, cân lại ống eppendorf còn chứa sinh
khối, trừ đi khối lượng ống eppendorf trống
ban đầu sẽ thu được lượng sinh khối ướt, ghi
lại kết quả.
Tiếp tục đem ống eppendorf chứa sinh
khối ướt đi sấy qua đêm ở nhiệt độ 50°C,
thu được lượng sinh khối khô, ghi lại kết
quả.
2.2.2.6. Xác định lượng cồn
Cho mẫu vào bình chưng cất đổ khoảng
100ml dung dịch rượu cần phân tích vào
bình cầu. Kết nối bình cầu với ống sinh hàn,
và đầu ra của sinh hàn vào bình hứng. Đảm
bảo kín khí để tránh bay hơi rượu ra ngoài.
Làm nóng từ từ. Ethanol sẽ bốc hơi trước
nước (do có nhiệt độ sôi ~78.3°C). Theo dõi
nhiệt kế, duy trì nhiệt độ khoảng 78–80°C.
Bỏ đi khoảng 5–10 mL đầu tiên (gọi là
"foreshots") vì có thể chứa methanol hoặc
tạp chất dễ bay hơi. Thu phần ethanol chưng
cất tiếp theo cho đến khi nhiệt độ tăng vượt
quá 85°C hoặc sản phẩm có mùi nhạt dần.
Xác định độ cồn bằng phương pháp bình tỷ
trọng :
- Đo bình tỷ trọng: đầu tiên ta rửa bình thật
sạch, sấy khô, làm lạnh trong bình hút ẩm,
sau đó đem cân bình không được m1(g)
- Tiếp theo, rốt nước cất vào bình đến trên
ngấn định mức, đặt bình vào nồi cách thủy,
nhiệt độ 20°C. sau 15 phút dùng giấy lọc
thấm nước tới ngấn bình đồng thấm khô
phần không chứa nước, lau khô nút và đậy
lại. Lấy bình ra khỏi bể ổn nhiệt, lau khô
phía ngoài bình rồi đem cân được m2(g).
- Tiếp theo đổ nước khỏi bình, tráng bình 2
đến 3 lần bằng dung dịch cần đo tỷ trọng rồi
cũng rót chất lỏng tới trên vạch, sau đó làm
tương tự như khi bình chứa nước cất, đem
cân được m3 (gam)
Sử dụng bình tỉ trọng và cân khối lượng
riêng
+ Cân khối lượng của bình đo tỉ trọng khô,
lạnh: m1 (g)
+ Cân khối lượng của bình đo tỉ trọng và
nước cất ở 20 độ C: m2 (g)
+ Cân khối lượng của bình đo tỉ trọng và
mẫu ở 20 độ C: m3 (g)
→ Kết quả tỉ trọng mẫu so với nước ở nhiệt
độ 20 độ C là:
III. KẾT QUẢ VÀ THẢO LUẬN 3.1 Lên men thẻo mẻ ( Batch)
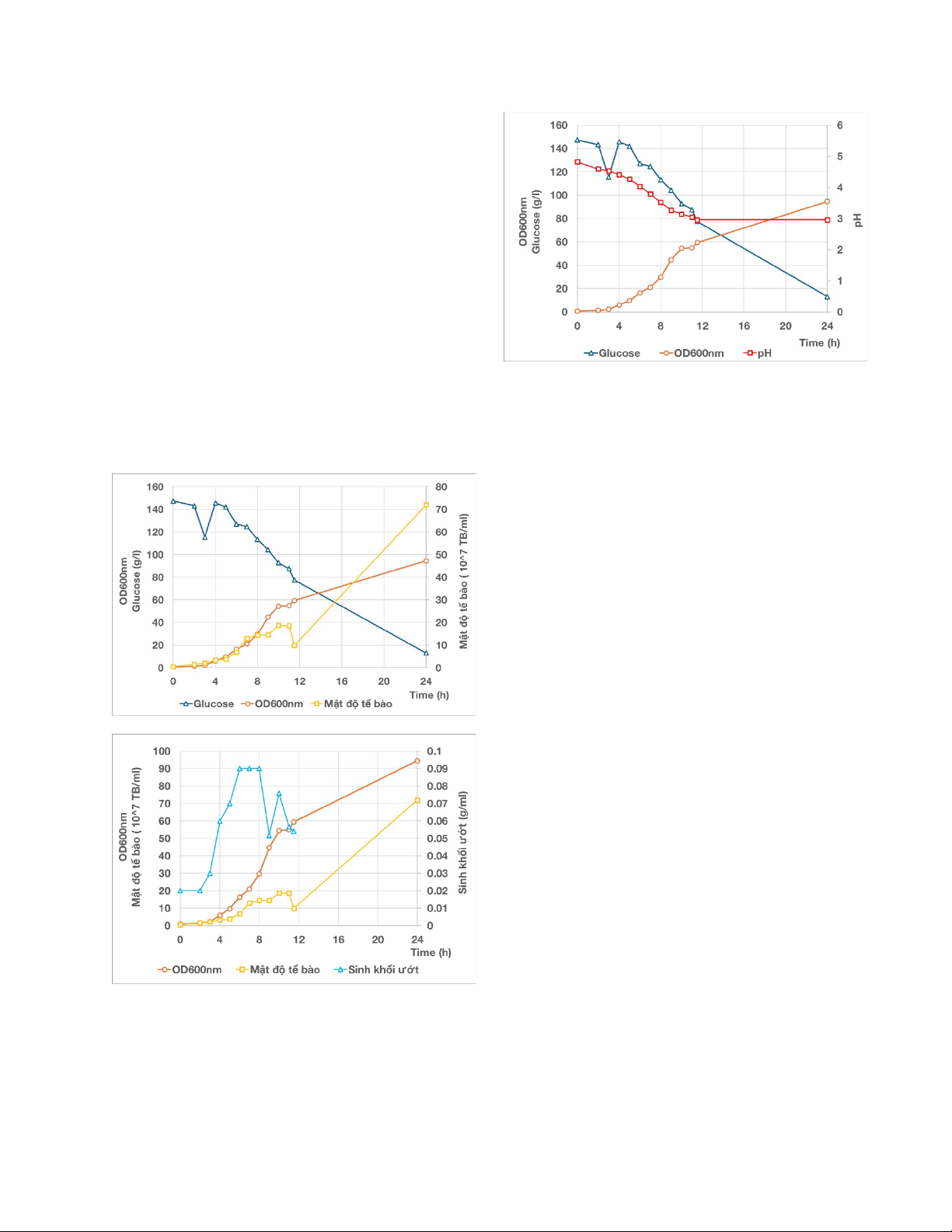
Chủng S. Cerevisiae được lên men theo mẻ
không cấp dưỡng trong 24h theo dõi. Sự
chuyển hóa đường glucose, sinh khối nấm
men trong quá trình lên men này được thể
hiện trên hình 1. Có thể thấy, đường glucose
là loại đường dễ sử dụng nên giảm nhanh rõ
rệt từ khoảng 147.35 g/L xuống khoảng
13.05 g/L trong suốt 24h. Tại thời điểm
3h,4h lượng đường lên xuống thất thường có
thể do sai sót trong quá trình đo đạc. Cùng
với sự giảm đường, mật độ nấm men tăng từ
0.5×107 tế bào/mL lên 18.68×107 tế bào/mL
tại 10 giờ và sau đó giảm dần xuống
9.92×107 tế bào/mL tại 12h, sau đó tăng
nhanh và đạt 72×107 tế bào/mL ( tại 24h lên
men).
Hình 1. Sự thay đổi của các thông số trong
24h lên men theo mẻ không cấp dưỡng
Lượng sinh khối ướt đo được khá tuyến tính
với mật độ nấm men và giá trị OD600nm.
Pha log kéo dài từ 3h->10h tương ứng với
giá trị OD600nm từ 2.2->54.4. Có một số
điểm thất thường như tại 9h lượng sinh khối
giảm trong khi mật độ và OD 600nm không
giảm có thể do thao tác sai trong quá trình
đo như lượng cân quá bé nên cân không
chính xác, khi ly tâm đổ dịch nổi có thể đổ
mất lượng sinh khối theo. Trong điều lên
men theo mẻ không cấp dưỡng, nấm men
lên men thu năng lượng và hình thành sinh
khối, nên ethanol được tạo ra cùng với sự
phát triển của nấm men nhưng chậm hơn.
Ethanol được tạo ra tại thời điểm 12h là
4.29% và 24h là 5.96%.
3.2 Lên men theo mẻ có cấp dưỡng (Fed-
batch)
Việc sử dụng nồng độ đường lên men cao
thường ức chế sự sinh trưởng và phát triển
của nấm men, ngoài ra có thể gây hiệu ứng
Crabtree hướng tế bào theo con đường lên
men thay vì hô hấp ngay cả có mặt oxy, gây
tăng hàm lượng cồn và giảm lượng sinh
khối1 (Perez-Samper et al., 2018). Trong
phương án lên men cấp dưỡng, sau 7h đầu
lên men với lượng thể tích ban đầu 1 lít,
tổng lượng đường glucose còn lại thấp (< 3
g/L) thì bắt đầu bổ sung dịch đường vào
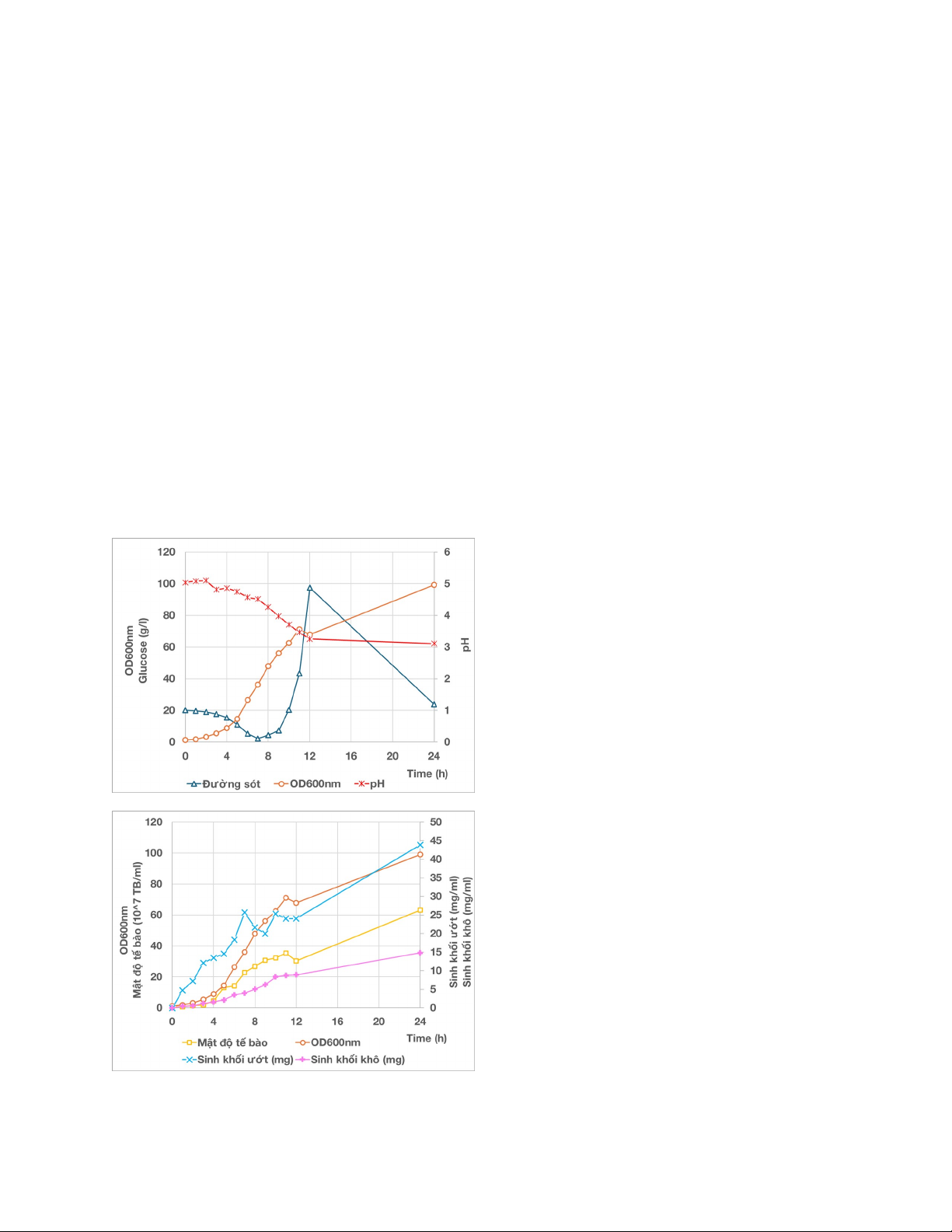
theo mô hình fed hàm số mũ có kèm theo
sục không khí vô trùng. Quá trình cấp dưỡng
diễn ra khi hết lượng dịch 180g đường còn
lại. Sự biến đổi các chỉ tiêu của quá trình lên
men được thể hiện trên các hình 2. Trước
khi cấp dưỡng, lượng đường glucose giảm
nhanh từ ban đầu về dưới 3g/L, mật độ tế
bào nấm men tăng lên khoảng 12.96×107 tế
bào/mL. Sau khi cấp dưỡng tế bào tiếp tục
phát triển nhanh, mật độ tế bào tăng lên
khoảng 35.36×107 tế bào/mL tại 11h sau đó
giảm nhẹ, sau đó tiếp tục tăng lên và đạt
63.2×107 tế bào/mL tại thời điểm 24h.
Lượng sinh khối ướt và khô đo được khá
tuyến tính với mật độ tế bào và giá trị
OD600nm. Pha log kéo dài từ 2h->11h
tương ứng với giá trị OD600nm từ 3.2-
>71.2. Giá trị OD cao hơn đáng kể so với
lên men batch và pha log được kéo dài hơn.
Hình 2. Sự thay đổi của các thông số trong
24h lên men theo mẻ cấp dưỡng
Lượng sinh khối ướt và khô trong lên men
fed-batch tăng ổn định và liên tục nhờ việc
cấp dưỡng glucose dần dần. Độ pH ở
phương pháp lên mem này ổn định hơn và
giảm chậm hơn ở phương pháp batch nhờ
việc bổ sung glucose từ từ, không bị dư thừa
glucose, hạn chế khả năng gây ra hiệu ứng
Crabtree ( hiện tượng nấm men chuyển hóa
glucose thành ethanol thay vì sinh khối).
Tuy nhiên, lượng đường cấp thêm vào cho
nấm men khá nhanh so với khả năng tiêu thụ
của chúng nên lượng đường này tăng nhiều
từ khoảng 9h đến 12h. Bên cạnh việc tạo
sinh khối, ethanol tạo ra trong quá trình này
tại 12h là 3.08% và tại 24h là 6.69%.
Có thể thấy, tại 12h độ cồn sản sinh ra trong
lên men Fed-Batch (3.08%) là thấp hơn so
với lên men batch (4.29%), tại 24h độ cồn
trong quá trình Fed-Batch nhiều hơn có thể
do việc cấp dưỡng glucose nhanh hơn so với
sự tiêu thụ của chủng dẫn đến việc xảy ra
hiệu ứng Crabtree sau 12h do tích tụ nhiều
glucose. Vì vậy để tránh hiện tượng này cần
tiến hành cấp dưỡng với tốc độ chậm hơn để
giúp nấm men duy trì sinh trưởng tốt hơn,
tránh được hiện tượng ức chế do nồng độ
glucose cao, đồng thời tối ưu hóa quá trình
chuyển hóa cơ chất cho sự phát triển tế bào
thay vì tạo ethanol.
4. KẾT LUẬN
Nghiên cứu này đã tiến hành so sánh hai
phương pháp nuôi cấy Batch và Fed-Batch –
trong quá trình lên men Saccharomyces
cerevisiae tạo sinh khối . Kết quả cho thấy,
phương pháp lên men fed-batch cho hiệu
suất sinh khối cao hơn, giảm bớt sự ức chế
sinh trưởng do nồng độ cơ chất quá cao từ
ban đầu, nấm men dễ thích nghi hơn, duy trì
sự chuyển hóa cơ chất ổn định. Vì vậy, nấm
men có thể duy trì pha sinh trưởng lâu hơn
và tạo ra sinh khối nhiều hơn, hạn chế đáng












![Giáo trình Vi sinh vật học môi trường Phần 1: [Thêm thông tin chi tiết nếu có để tối ưu SEO]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251015/khanhchi0906/135x160/45461768548101.jpg)





![Bài giảng Sinh học đại cương: Sinh thái học [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250812/oursky02/135x160/99371768295754.jpg)



![Đề cương ôn tập cuối kì môn Sinh học tế bào [Năm học mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2026/20260106/hoang52006/135x160/1251767755234.jpg)

![Cẩm Nang An Toàn Sinh Học Phòng Xét Nghiệm (Ấn Bản 4) [Mới Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251225/tangtuy08/135x160/61761766722917.jpg)