
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC BÁCH KHOA HÀ NỘI
--------- o0o --------
CAO XUÂN THẮNG
NGHIÊN CỨU QUÁ TRÌNH CHẾ TẠO NANO TINH THỂ TiO2
Ở NHIỆT ĐỘ THẤP
Chuyên ngành: QUÁ TRÌNH & THIẾT BỊ CÔNG NGHỆ HÓA HỌC
Mã số: 62.52.77.01
LUẬN ÁN TIẾN SĨ KỸ THUẬT
Hà Nội - 2012

Vật liệu nano tinh thể TiO2
LỜI CAM ĐOAN
Tôi xin cam đoan đây là công trình nghiên cứu do tôi thực hiện. Các số liệu và kết
quả trong luận án là trung thực và chưa được công bố trong bất kỳ công trình
khoa học nào khác.
Hà Nội, 2012
Tác giả
Cao Xuân Thắng

Vật liệu nano tinh thể TiO2
LỜI CẢM ƠN
Bản luận án này hoàn thành dưới sự hướng dẫn nhiệt tình của GS.TS Phạm Văn
Thiêm, TS Nguyễn Văn Xá. Tác giả xin được bày tỏ lòng biết ơn sâu sắc. Tác giả
cũng xin tỏ lòng biết ơn chân thành đối với sự giúp đỡ tận tình của các thầy các cô
trong Bộ môn Quá trình & Thiết bị Công nghệ Hóa, đã nhiều ý kiến có giá trị khoa
học để luận án đạt kết quả tốt.
Tác giả xin gửi lời cám ơn tới các cán bộ Viện Nghiên cứu & Phát triển các Sản
phẩm Tự nhiên, tiền thân là Trung tâm Giáo dục & Phát triển Sắc ký - Trường Đại
học Bách khoa Hà Nội và các khóa sinh viên chuyên ngành Quá trình Thiết bị &
Công nghệ hóa đã cộng tác, trao đổi, thảo luận và đóng góp cho luận án.
Sự ủng hộ và động viên của gia đình là chỗ dựa vững chắc. Tác giả xin được bày tỏ
sự trân trọng và lòng biết ơn sâu nặng.
Hà Nội, 2012
Tác giả
Cao Xuân Thắng

Vật liệu nano tinh thể TiO2
KÝ HIỆU MỘT SỐ CHỮ VIẾT TẮT
TTIP
Tetraisopropoxide
CMC
Nồng độ chất hoạt động bề mặt
PEPECOO-NH+
Carboxylate perfluoropolyether
TOPO
Triotylphosphine
CVD
Lắng đọng hóa học
PVD
Lắng đọng vật lý
SEM
Hiển vi điện tử quyét
TEM
Hiển vi điện tử truyền qua
X- Ray
Nhiễu xạ tia X
Micro Raman
Tán xạ Micro Raman
Vật liệu nano tinh thể TiO2
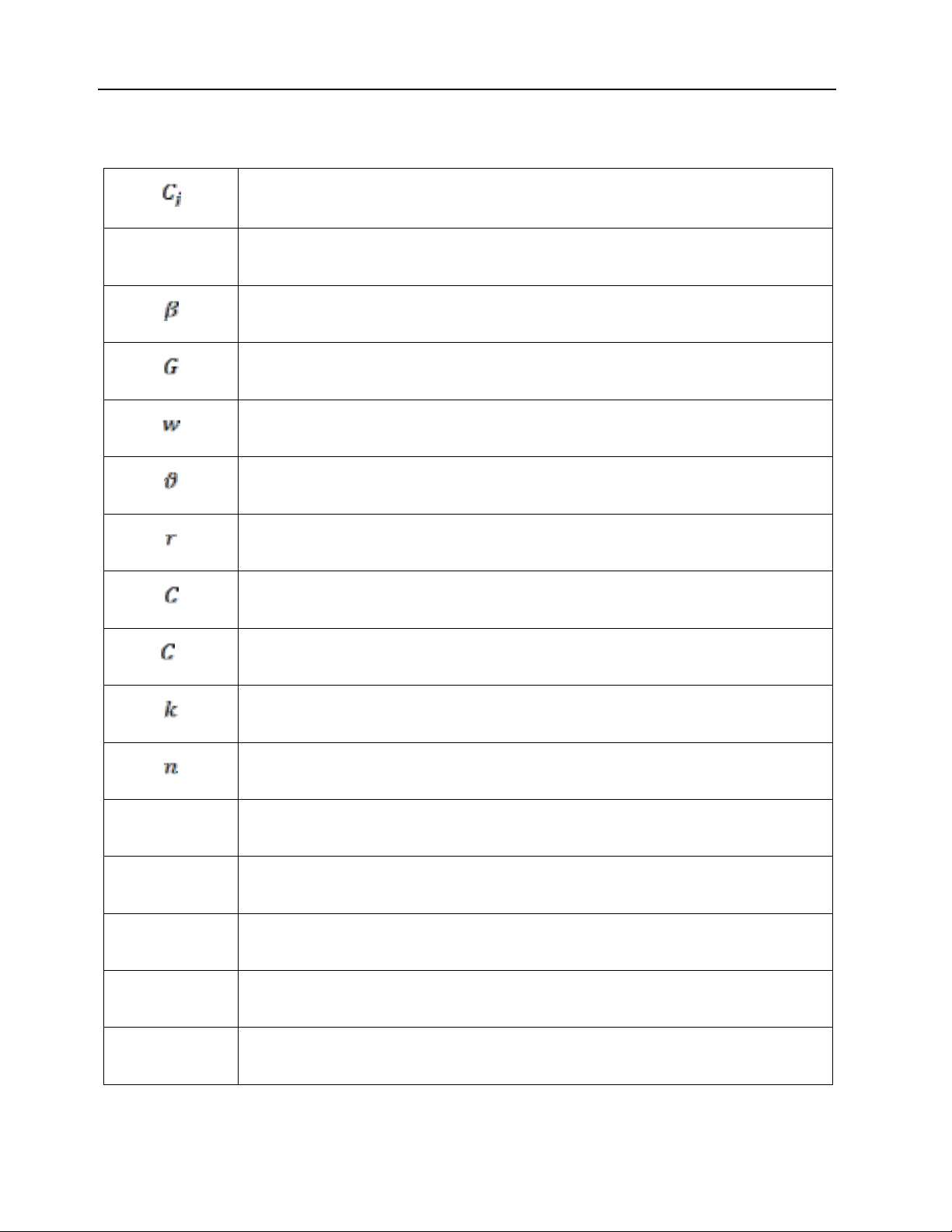
DANH MỤC CÁC KÝ HIỆU TOÁN HỌC
Nồng độ mol của cấu tử j (kmol/m3)
D Hệ số khuếch tán (m2/h).
Hệ số cấp khối (m/h).
Dòng phát sinh (kmol/m3h).
Vận tốc dòng đối lưu (m/h).
Hệ số tỷ lượng.
Tốc độ phản ứng.
Nồng độ của TiCl4 tại thời gian t = τ (mol/ml).
0 Nồng độ TiCl4 tại thời điểm ban đầu (t=0) (mol/ml).
Hằng số tốc độ phản ứng (s-1).
Bậc phản ứng
m Khối lượng của sản phẩm TiO2 thu được sau quá trình tổng hợp
yu Giá trị đo được tại lần lặp thứ u
S2i Phương sai chung
S2ts Phương sai tái sinh chung
fi Số bậc tự do của mẫu


























