B Y TỘ Ế
C C QU N LÝ D CỤ Ả ƯỢ
-------
C NG HÒA XÃ H I CH NGHĨA VI T NAMỘ Ộ Ủ Ệ
Đc l p - T do - H nh phúcộ ậ ự ạ
---------------
S : 737/QĐ-QLDốHà N i, ngày 22 tháng 12 năm 2021ộ
QUY T ĐNHẾ Ị
V VI C S A ĐI THÔNG TIN THU C ĐC C P GI Y ĐĂNG KÝ L U HÀNH T IỀ Ệ Ử Ổ Ố ƯỢ Ấ Ấ Ư Ạ
VI T NAM BAN HÀNH KÈM THEO CÁC QUY T ĐNH C P GI Y ĐĂNG KÝ L U HÀNHỆ Ế Ị Ấ Ấ Ư
C A C C QU N LÝ D CỦ Ụ Ả ƯỢ
C C TR NG C C QU N LÝ D CỤ ƯỞ Ụ Ả ƯỢ
Căn c Lu t D c s 105/2016/QH13 ngày 06/4/2016;ứ ậ ượ ố
Căn c Ngh đnh s 75/2017/NĐ-CP ngày 20/6/2017 c a Chính ph quy đnh ch c năng, nhi m ứ ị ị ố ủ ủ ị ứ ệ
v , quy n h n và c c u t ch c c a B Y t ;ụ ề ạ ơ ấ ổ ứ ủ ộ ế
Căn c Ngh đnh s 54/2017/NĐ-CP ngày 08/5/2017 c a Chính ph quy đnh chi ti t m t s ứ ị ị ố ủ ủ ị ế ộ ố
đi u và bi n pháp thi hành Lu t D c;ề ệ ậ ượ
Căn c Ngh đnh s 155/2018/NĐ-CP ngày 12/11/2018 c a Chính ph s a đi, b sung m t s ứ ị ị ố ủ ủ ử ổ ổ ộ ố
quy đnh liên quan đn đi u ki n đu t kinh doanh thu c ph m vi qu n lý nhà n c c a B Y ị ế ề ệ ầ ư ộ ạ ả ướ ủ ộ
t ;ế
Căn c Ngh đnh s 30/2020/NĐ-CP ngày 05/3/2020 c a Chính ph v công tác văn th ;ứ ị ị ố ủ ủ ề ư
Căn c Thông t s 32/2018/TT-BYT ngày 12/11/2018 c a B tr ng B Y t quy đnh vi c ứ ư ố ủ ộ ưở ộ ế ị ệ
đăng ký l u hành thu c, nguyên li u làm thu c;ư ố ệ ố
Căn c Thông t s 29/2020/TT-BYT ngày 31/12/2020 c a B tr ng B Y t s a đi, b sung ứ ư ố ủ ộ ưở ộ ế ử ổ ổ
và bãi b m t s văn b n quy ph m pháp lu t do B tr ng B Y t ban hành, liên t ch ban ỏ ộ ố ả ạ ậ ộ ưở ộ ế ị
hành;
Căn c vào h s đăng ký l u hành thu c l u t i C c Qu n lý D c;ứ ồ ơ ư ố ư ạ ụ ả ượ
Theo đ ngh c a Tr ng phòng Đăng ký thu c, C c Qu n lý D c.ề ị ủ ưở ố ụ ả ượ
QUY T ĐNH:Ế Ị
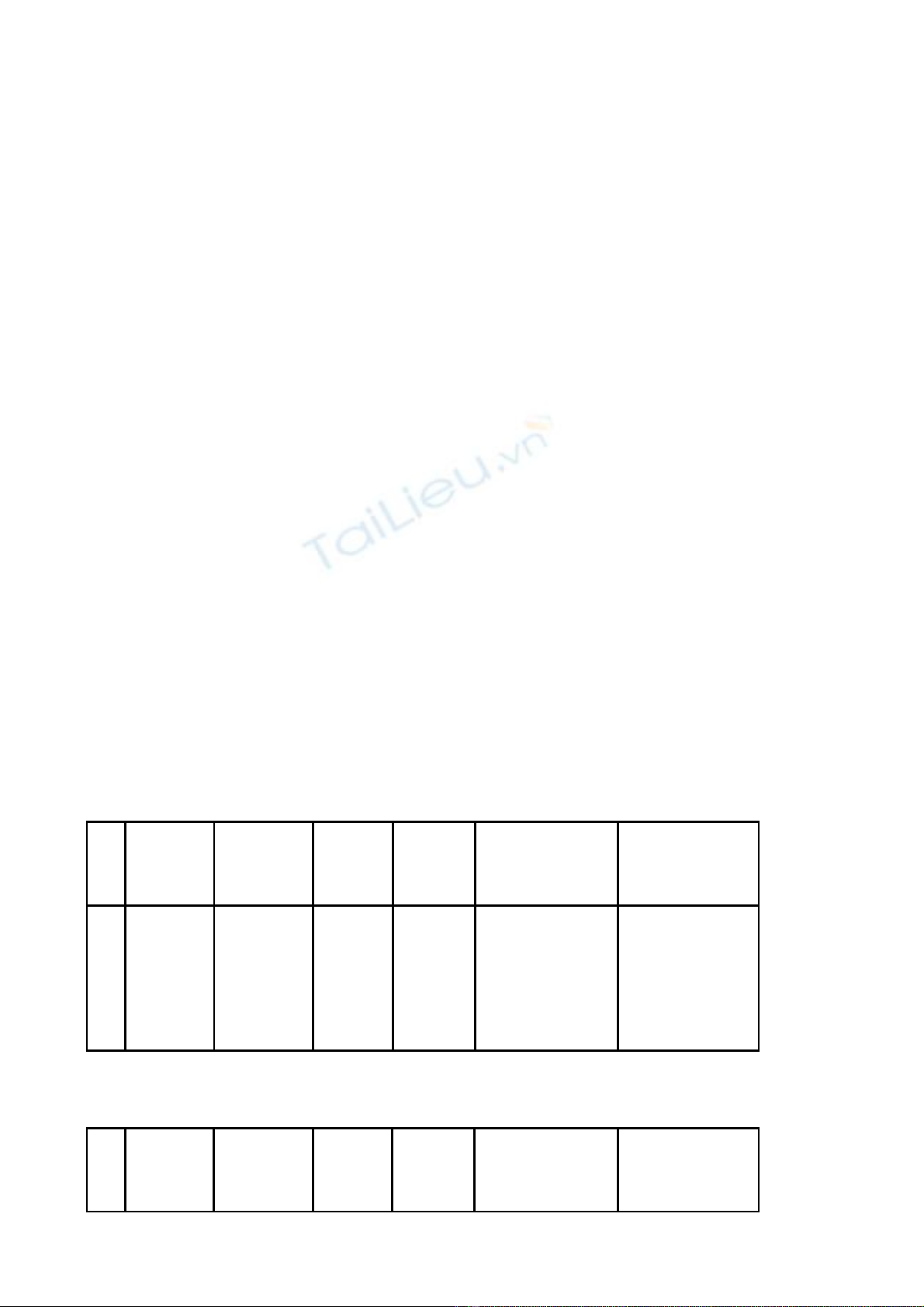
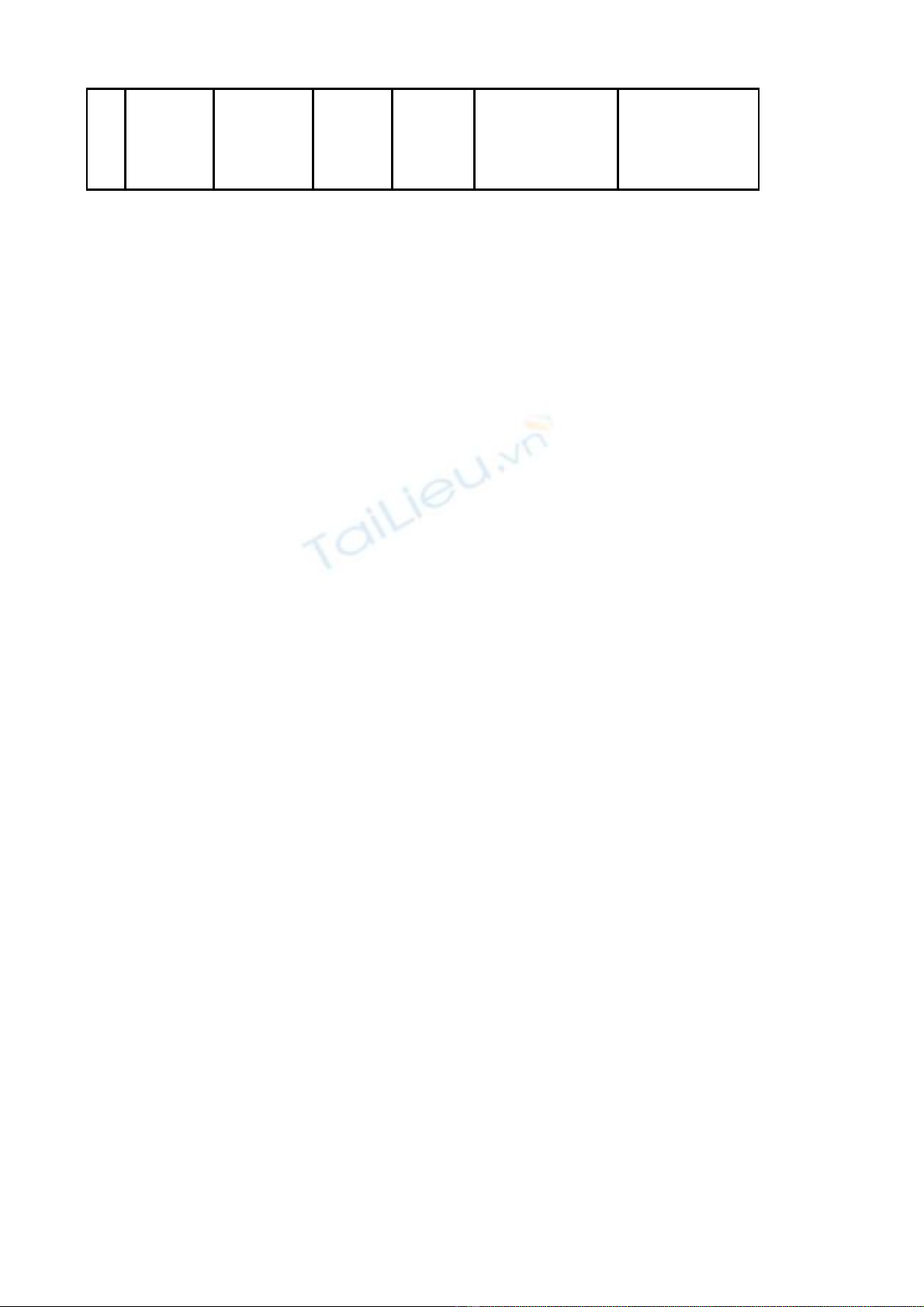
Đi u 1.ề S a đi m t s thông tin thu c đc c p gi y đăng ký l u hành t i Vi t Nam ban hành ử ổ ộ ố ố ượ ấ ấ ư ạ ệ
kèm theo các Quy t đnh c p gi y đăng ký l u hành c a C c Qu n lý D c (Ph l c kèm theo ế ị ấ ấ ư ủ ụ ả ượ ụ ụ
Quy t đnh này).ế ị
Các thông tin khác c a thu c đc c p gi y đăng ký l u hành t i Vi t Nam ban hành kèm theo ủ ố ượ ấ ấ ư ạ ệ
các Quy t đnh c p gi y đăng ký l u hành thu c t i Ph l c kèm theo Quy t đnh này không ế ị ấ ấ ư ố ạ ụ ụ ế ị
thay đi.ổ