06/05/2013
1
CƠ SỞ LÝ THUYẾT
HÓA PHÂN TÍCH 1
Năm học: 2012 – 2013
Giáo viên: Nguyễn Quốc Thắng
NỘI DUNG CHƯƠNG TRÌNH
1.PHÂN BỐ CHƯƠNG TRÌNH
2.TÀI LIỆU THAM KHẢO
3.KẾ HOẠCH THI VÀ PHÂN BỐ ĐIỂM
4.ĐỀ CƯƠNG BÀI GIẢNG
1.PHÂN BỐ CHƯƠNG TRÌNH
Nội dung Số tiết
Chương 1:
Đại cương về Hoá phân tích 2
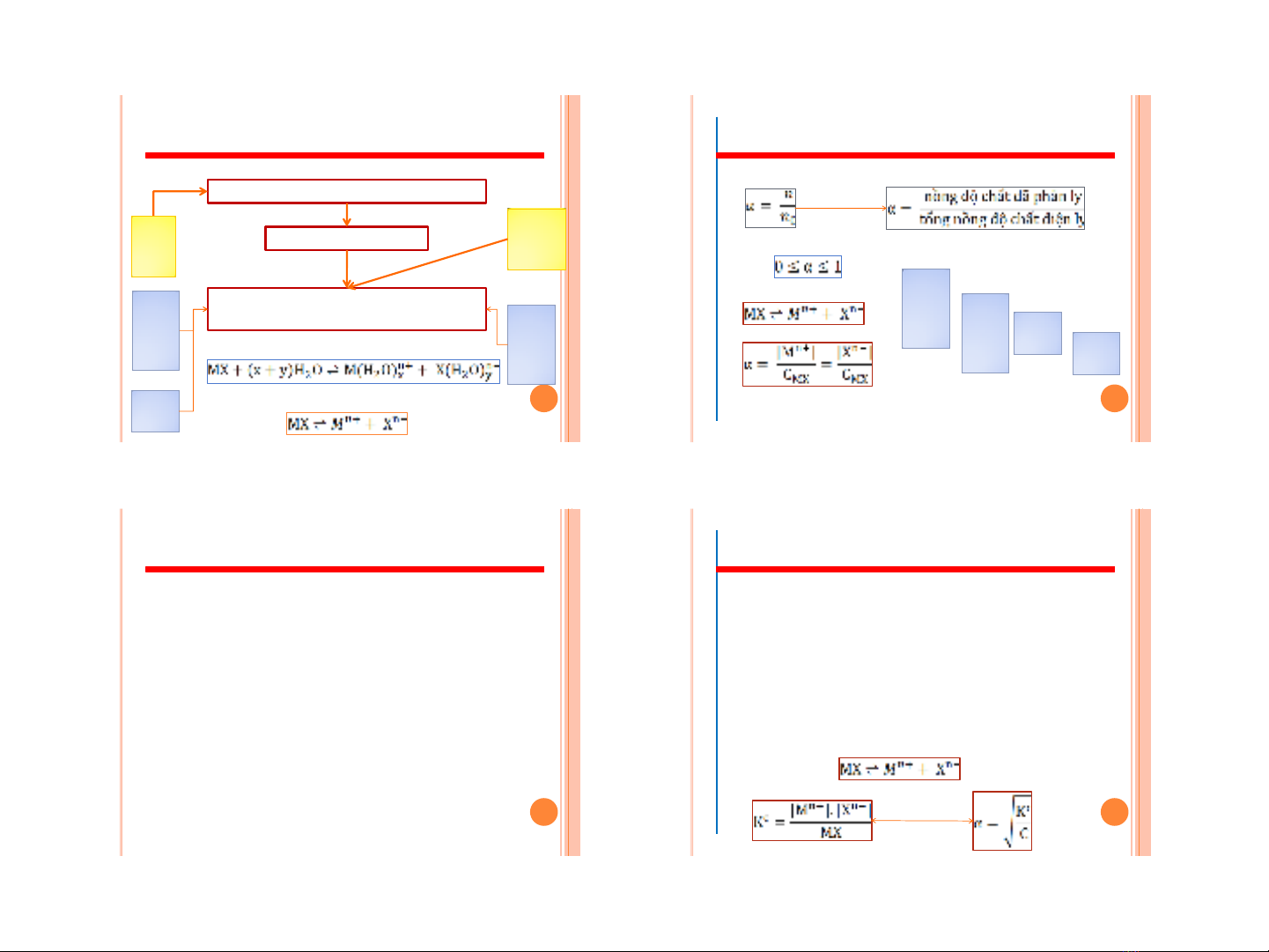
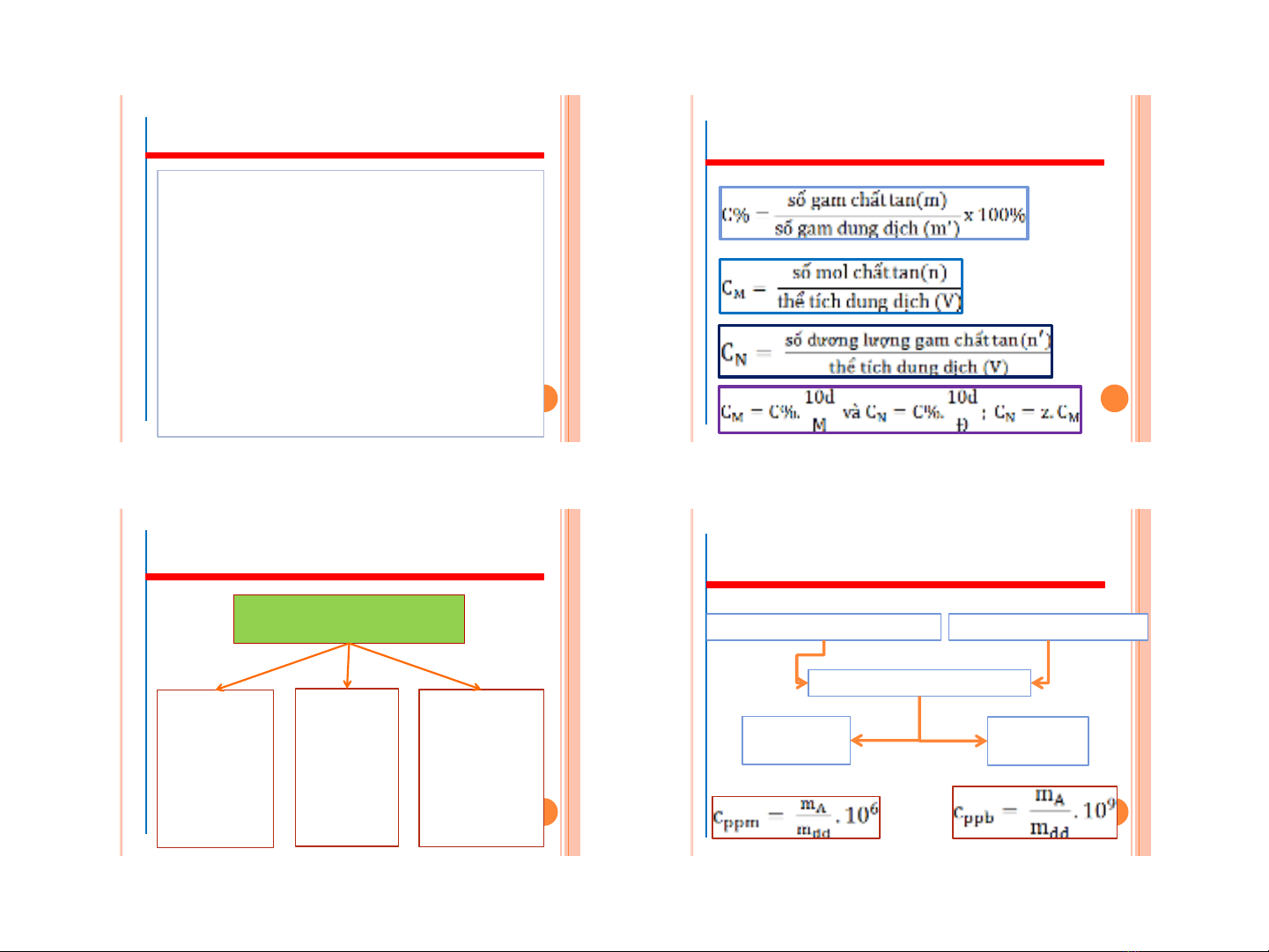
Chương 2: Các khái niệm cơ bản trong dung dịch chất điện ly 2
Chương 3: Cân bằng của phản ứng acid - baz 10
Chương 4: Cân bằng của phản ứng tạo phức 4
Chương 5: Cân bằng của phản ứng tạo hợp chất ít tan 4
Chương 6: Cân bằng của phản ứng oxi hoá – khử 5
Chương 7: Các phản ứng ion trong dung dịch nước 3
2. TÀI LIỆU THAM KHẢO
1. Trần Tứ Hiếu, Hoá học phân tích, NXB ĐH QG HN,
2002
2. Nguyễn Thạc Cát, Từ Vọng Nghi, Đào Hữu Vinh, Cơ sở
lý thuyết hoá phân tích, NXB Giáo dục, 1996.
3. Hoàng Minh Châu, Từ Văn Mặc, Từ Vọng Nghi, Cơ sở
hoá học phân tích, NXB khoa học và kỹ thuật, Hà Nội,
2002.
4. Từ Vọng Nghi, Hoá học phân tích, Phần 1, NXB
ĐHQGHN
5. Nguyễn Thanh Khuyến, Nguyễn Thị Xuân Mai, Cân
bằng ion trong Hoá phân tích, tủ sách ĐH KHTN TP
HCM