1
1
1
1
1
1
HÓA ĐẠI CƯƠNG – PHẦN CẤU TẠO
Chương 5
MÔ HÌNH LIÊN KẾT CỘNG HÓA TRỊ ĐƠN GIẢN
(KHÔNG DÙNG CƠ HỌC LƯỢNG TỬ)
2
2
2
2
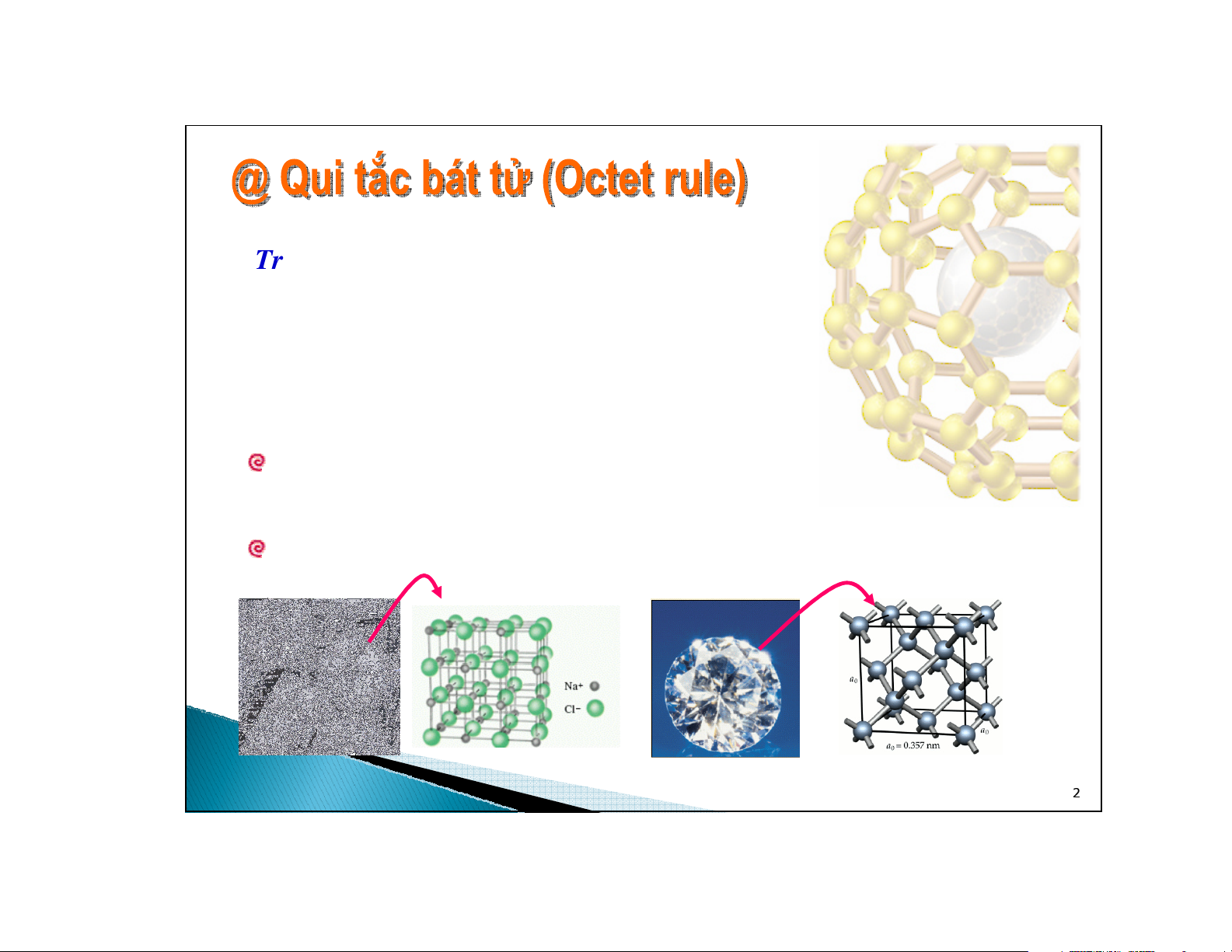
Trong một phân tử, các nguyên tửcó khuynh hướng kết hợp với nhau
bằng cách tạo các liên kết sao cho cấu trúc đạt được cấu trúc bền
vững của khí trơ với
8e-
electron (2e
-
cho He) ởlớp ngoài cùng.
Để đạt được cấu trúc bền vững của khí trơ:
Chuyển electron từnguyên tử
này sang nguyên tửkhác.
Các nguyên tửgóp chung electron.
⇔Liên kết ion
⇔Liên kết cộng hóa trị
Muối ănKim cương
2 cách
2
2
3
3
3
3
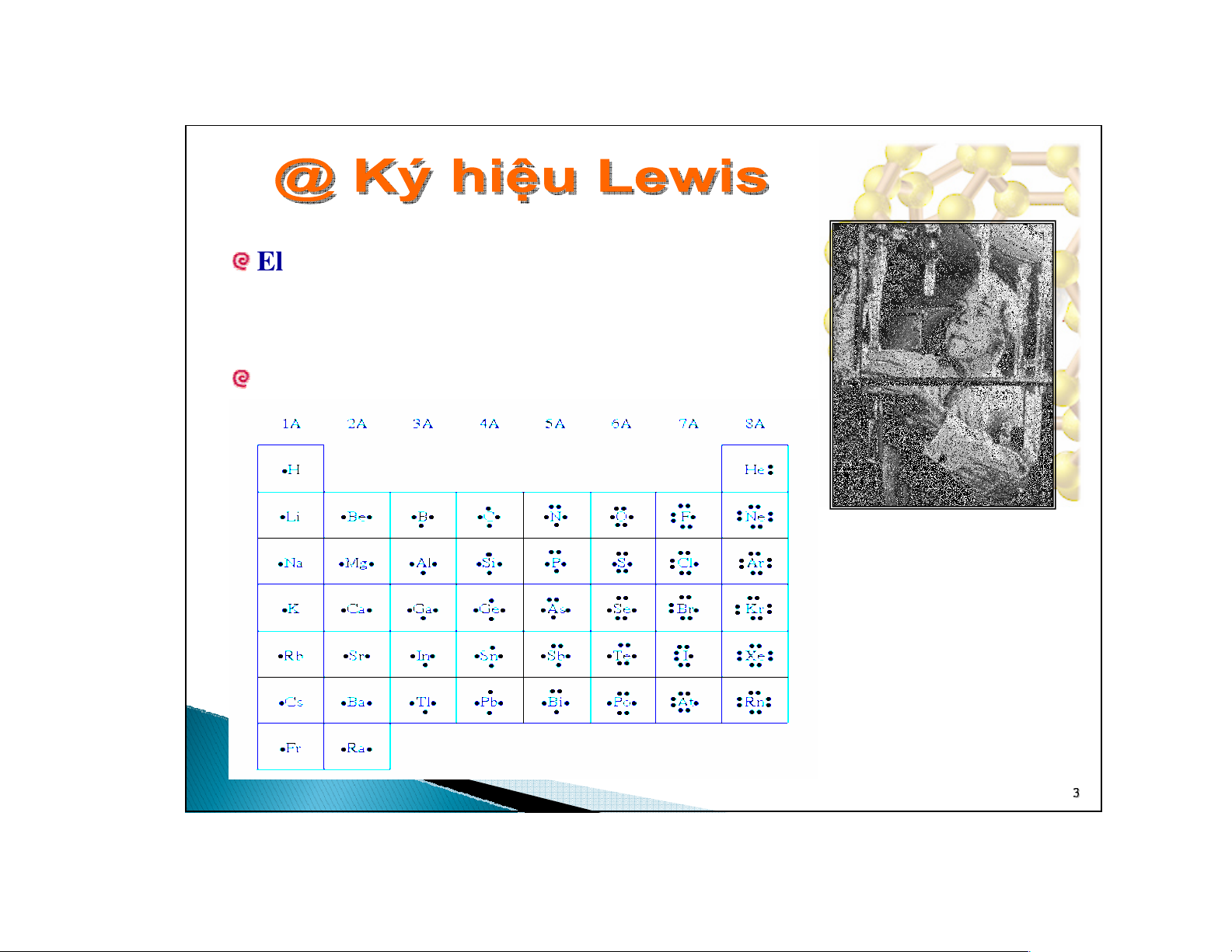
Electron hoá trị đóng vai trò quan trọng trong
việc tạo liên kết hóa học. Được biểu thịtheo ký
hiệu Lewis.
Ký hiệu Lewis
G. N. Lewis
(1875-1946, Mỹ)
•
Si
•
••
Ký hiệu nguyên tốbiểu thịhạt nhân và
các electron bên trong.
Dấu chấm xung quanh biểu thịelectron
hóa trị.
3
3

4
4
4
4
Cl
H
?
Liên kết sinh ra từcác
nguyên tửdùng chung
electron.
4
4

5
5
5
5
Liên kết CHT được hình thành giữa những nguyên tử cùng một nguyên tố hay của
hai nguyên tố có sự chênh lệnh nhỏ về độ âm điện (X < 2):
Các nguyên tử có xu hướng sử dụng chung electron để đạt tới cấu hình lớp vỏ ngoài
cùng bền vững có 8 electron
Các nguyên tửdùng chung điện tử: 2e (liên kết đơn); 4e (liên kết đôi); 6e (liên kết ba)
Sựhình thành liên kết CHT
Mô hình LK cộng hóa trịtheo Lewis
Thuyết liên kết cộng hóa trịtheo Lewis











![Bài tập Vật lý sóng: Tổng hợp bài tập 6 [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250805/oursky04/135x160/401768817575.jpg)














