
HUI© 2006General Chemistry:Slide 1 of 48
HÓA ĐI C NGẠ ƯƠ
Ch ng 4: Liên k t hóa h c và c u t o phân tươ ế ọ ấ ạ ử

HUI© 2006General Chemistry:Slide 2 of 48
N i dungộ
1. Nh ng khái ni m c b n v liên k t hóa ữ ệ ơ ả ề ế
h cọ
2. Liên k t ionế
3. Liên k t c ng hóa trế ộ ị
4. Liên k t kim lo iế ạ
5. Liên k t hyđroế
6. Liên k t Van Der Vaalế
7. Bài t pậ

HUI© 2006General Chemistry:Slide 3 of 48
4.1 Nh ng khái ni m c b n v liên k t hoá ữ ệ ơ ả ề ế
h cọ
4.1.1 B n ch t c a liên k t.ả ấ ủ ế
– Theo quan đi m hi n đi các lo i liên k t hoá h c đu có b n ể ệ ạ ạ ế ọ ề ả
ch t đi n vì suy cho cùng là do t ng tác c a các h t mang đi n ấ ệ ươ ủ ạ ệ
là h t nhân nguyên t và electron ạ ử
– Trong liên k t hóa h c ch có electron c a các phân l p ngoài ế ọ ỉ ủ ớ
cùng th c hi n: ns, np, (n-1)d và (n-2)f (chúng đc g i là các ự ệ ượ ọ
electron hóa tr )ị
–Theo CHLT, nghiên c u liên k t là quá trình nghiên c u s ứ ế ứ ự
phân b m t đ electron trong tr ng h t nhân c a các h t ố ậ ộ ườ ạ ủ ạ
nhân c a các nguyên t t o ra phân t .ủ ử ạ ử
–Các lo i liên k t ch y u trong hoá h c là liên k t c ng hoá tr ạ ế ủ ế ọ ế ộ ị
và liên k t ion,ngoài ra còn có các liên k t kim lo i, và các liên ế ế ạ
k t y u h n liên k t c ng hoá tr là liên k t Van der Valls, liên ế ế ơ ế ộ ị ế
k t hydroế
HUI© 2006General Chemistry:Slide 4 of 48
4.1.2 M t s đc tr ng c a liên k tộ ố ặ ư ủ ế
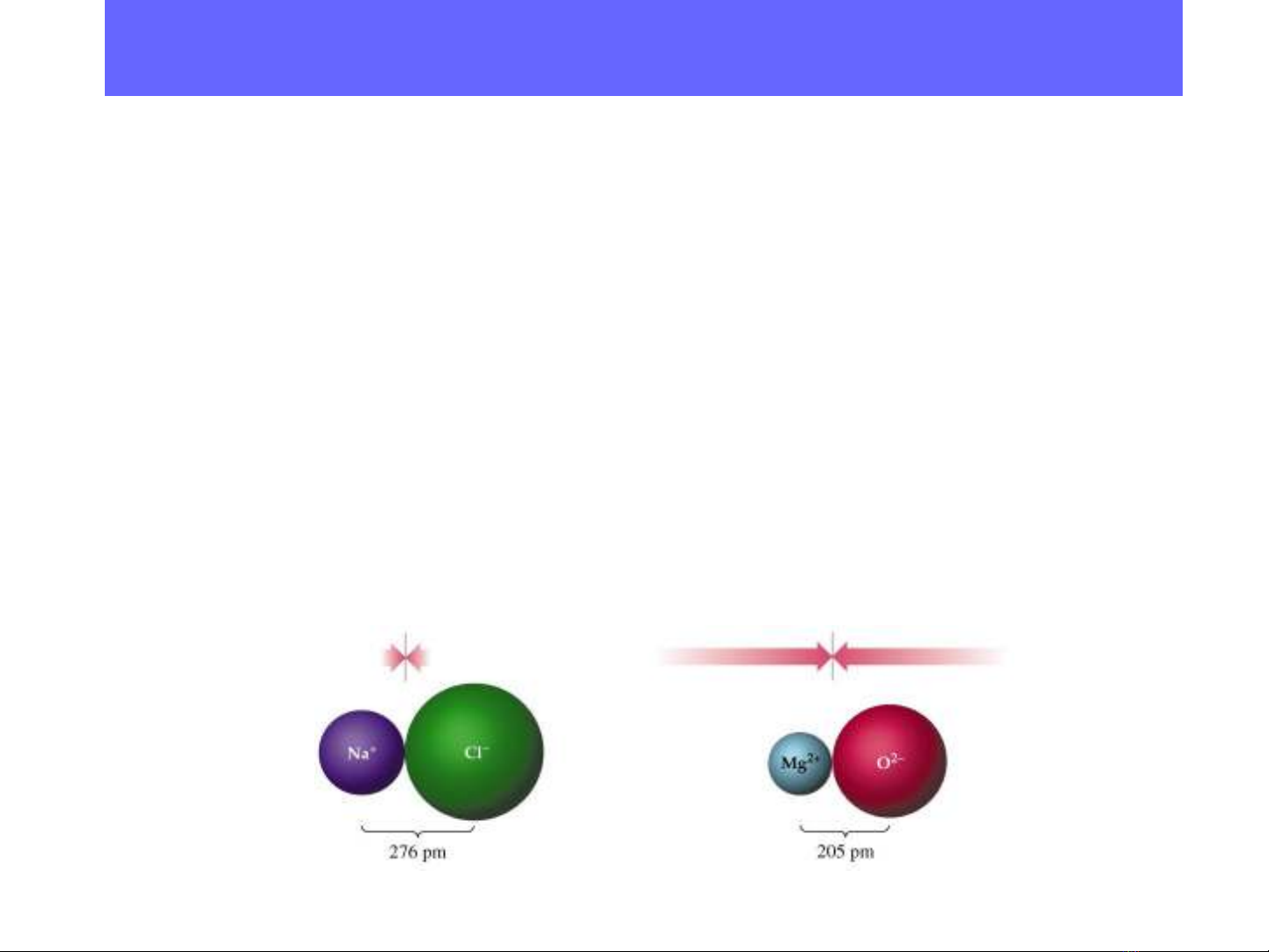
•Công th c tính g n đúng đ dài liên k t (khi các nguyên t có đ ứ ầ ộ ế ử ộ
âm đi n g n b ng nhau): dệ ầ ằ A-B= rA + rB
•N u đ âm đi n khác nhau nhi u thì: dế ộ ệ ề A-B = rA + rB- 0,09| χA - χB |
. 1. Đ dài liên k tộ ế :
là kho ng cách gi a hai h t nhân nguyên t liên k t v i nhau. ả ữ ạ ử ế ớ
Ví du Liên k t: H-FếH-Cl H-Br H-I
d (A0) 0,92 1,28 1,42 1,62

HUI© 2006General Chemistry:Slide 5 of 48
Đ dài liên k tộ ế
Đ dài liên k t ph thu c vào: ộ ế ụ ộ
– Ki u liên k t, đ b i liên k t: đ dài liên k t gi m ể ế ộ ộ ế ộ ế ả
khi đ b i liên k t tăng.ộ ộ ế
–Năng l ng liên k t: n u năng l ng liên k t cao thì ượ ế ế ượ ế
đ dài liên k t nhộ ế ỏ
–Đ dài liên k t ph thu c vào tr ng thái hoá tr c a ộ ế ụ ộ ạ ị ủ
các nguyên t , đ b n h p ch t.ố ộ ề ợ ấ
–Đ dài liên k t có th xác đnh chính xác b ng th c ộ ế ể ị ằ ự
nghi m nh các ph ng pháp v t lý hi n đi : nhi u ệ ờ ươ ậ ệ ạ ễ
x r ngen, quang ph phân t …Còn tính toán b ng lý ạ ơ ổ ử ằ
thuy t thì ch cho đ chính xác t ng điế ỉ ộ ươ ố













![Tài liệu Hướng dẫn thực tập môn Hóa nước [Chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251231/kimphuong1001/135x160/22661767942303.jpg)
![Đề cương ôn tập Hóa sinh [chuẩn nhất/chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251231/tomhum321/135x160/93461767773134.jpg)











