
HồThịCẩm Hòai, PhD
htchoai@hcmuns.edu.vn

Xét trường hợp đơn giản của dung dịch gồm hai chất (A) và
(B) hòa tan vào nhau.
Dung dịch được gọi là lý tưởng khi tương tác giữa các
phân tử loại (A) hay (B) và tương tác giữa các phân tử
(A) và (B) giống nhau.
Nghĩa là sự hòa tan của (A) và (B) không kèm theo sự trao
đổi nhiệt hay sự thay đổi thể tích.

Chất lỏng tinh chất:
Xem một bình kín chứa chất lỏng (A) cân bằng với pha hơi của
nó. Giả sử hơi lý tưởng, điều kiện cân bằng là
μ*A (l) = μoA(k)(p*A, T)
Với “*” là ký hiệu của chất tinh khiết
Mà ta đã biết: μoA(k)(p*A, T) = μoA(1atm, T) + RTlnp*A
Nên ta có thể viết: μ*A (l) = μoA+ RTlnp*A
Cho hỗn hợp lỏng:
Điều kiện cân bằng là: μA(l) = μA(k)
Mà μA(k) = μoA+ RTlnpA
Vậy:μA(l) = μA(k) = μoA+ RTlnpA
So với μ*A (l) = μoA+ RTlnp*A
Ta có: μA(l) = μ*A (l) + RTln(pA/p*A)

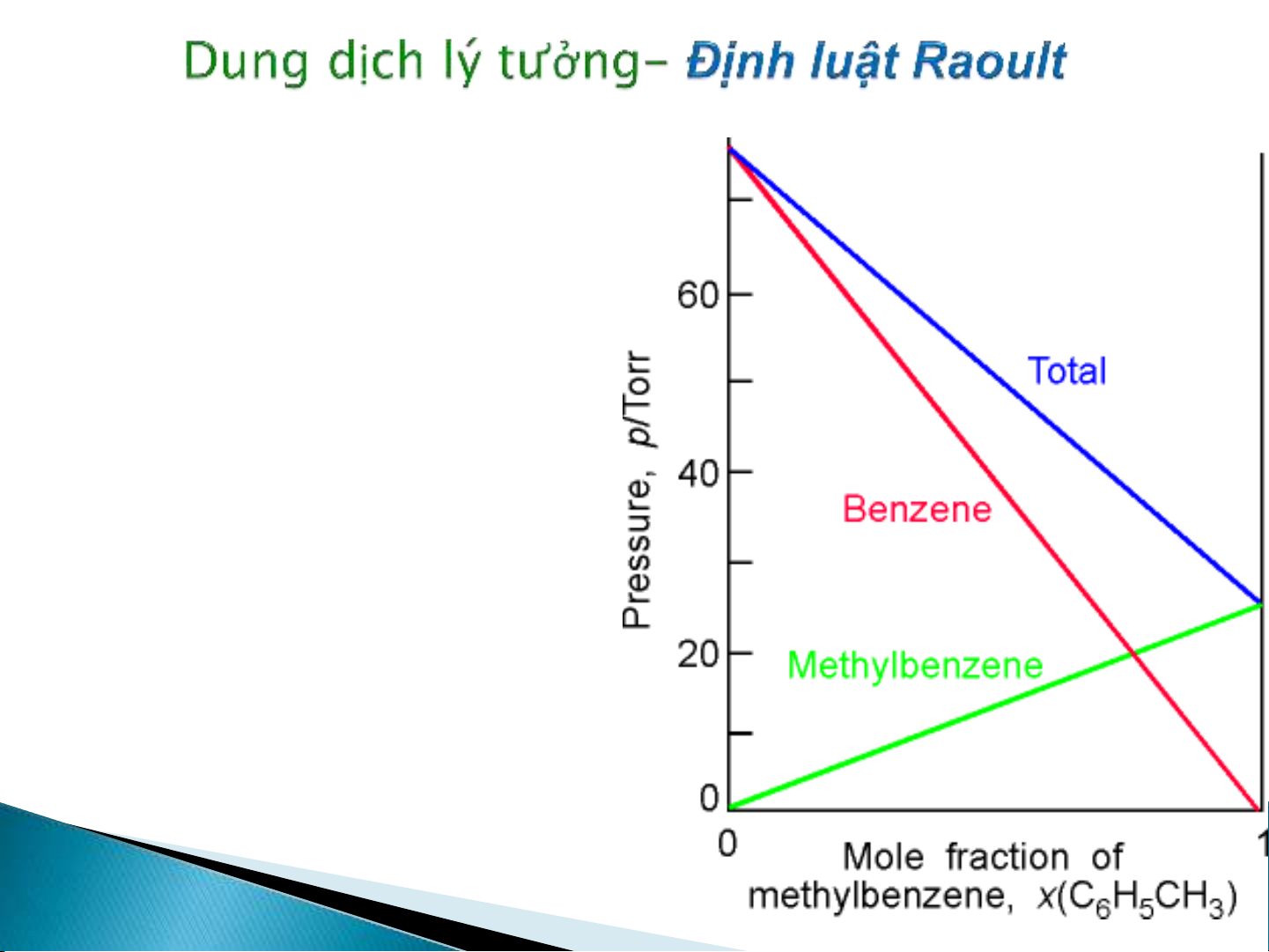
Định luật Raoult:
Thí nghiệm trên hỗn hợp benzen và toluen có cấu trúc tương
tự nhau để có thể tạo thành dung dịch lý tưởng cho biết pA/p*A
tỷ lệ với phân mol của cấu tử A trong dung dịch.
Giả sử có hai cấu tử A và B hòa tan vào nhau, biểu thức của
định luật Raoult là
pA= xAp*A
với pAlà áp suất dung môi A trên bề mặt
p*A là áp suất dung môi A tinh khiết
Hay: xB= 1- xA= (p*A- pA) / p*A
Nghĩa là khi hòa tan cấu tử B vào dung môi A, độ giảm
tương đối của áp suất hơi của dung môi bằng phân mol
của chất hòa tan. Điều này có ảnh hưởng ntn lên nhiệt độ
sôi của dd so với chất tinh khiết???
pA= xAp*A
với :pAlà áp suất dung
môi A trên bề mặt
p*A là áp suất dung môi A
tinh khiết .
Kết hợp với biểu thức đã
có:
μA(l) = μ*A (l) + RTln(pA/p*A)
Ta có biểu thức cho dung
dịch lý tưởng sau:
μA= μ*A + RTlnxA
Hay: μA-μ*A = RTlnxA




![Bài giảng Hóa lý thực phẩm [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250716/kimphuong1001/135x160/849_bai-giang-hoa-ly-thuc-pham.jpg)
![Câu hỏi ôn tập Hóa lý [chuẩn nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250709/kimphuong1001/135x160/51111752043440.jpg)
![Bài giảng Hóa lý 1: Tổng hợp kiến thức [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250704/tiepnguyen438@gmail.com/135x160/6631751621117.jpg)



















