BỘ 12 ĐỀ THI GIỮA HỌC KÌ 2
MÔN HÓA HỌC LỚP 10
NĂM 2020-2021 CÓ ĐÁP ÁN

MỤC LỤC
1. Đề thi giữa học kì 2 môn Hóa học lớp 10 năm 2020-2021 có đáp án – Trường
THPT Lê Qúy Đôn, Hải Phòng
2. Đề thi giữa học kì 2 môn Hóa học lớp 10 năm 2020-2021 có đáp án – Trường
THPT Nguyễn Thị Minh Khai
3. Đề thi giữa học kì 2 môn Hóa học lớp 10 năm 2020-2021 có đáp án – Trường
THPT Lương Văn Can
4. Đề thi giữa học kì 2 môn Hóa học lớp 10 năm 2020-2021 có đáp án – Trường
THPT Ngô Gia Tự
5. Đề thi giữa học kì 2 môn Hóa học lớp 10 năm 2020-2021 có đáp án – Trường
THPT Phan Ngọc Hiển
6. Đề thi giữa học kì 2 môn Hóa học lớp 10 năm 2020-2021 có đáp án – Sở GD&ĐT
Bắc Ninh
7. Đề thi giữa học kì 2 môn Hóa học lớp 10 năm 2020-2021 có đáp án – Trường
THPT Thị Xã Quảng Trị
8. Đề thi giữa học kì 2 môn Hóa học lớp 10 năm 2020-2021 có đáp án – Trường
THPT Bình Hưng Hòa
9. Đề thi giữa học kì 2 môn Hóa học lớp 10 năm 2020-2021 có đáp án – Trường
THPT Liễn Sơn
10. Đề thi giữa học kì 2 môn Hóa học lớp 10 năm 2020-2021 có đáp án – Sở
GD&ĐT Quảng Ngãi
11. Đề thi giữa học kì 2 môn Hóa học lớp 10 năm 2020-2021 có đáp án – Trường
THPT Tây Thạnh
12. Đề thi giữa học kì 2 môn Hóa học lớp 10 năm 2020-2021 có đáp án – Trường
THPT Trần Quốc Toản
Mã đề 101 Trang 1/4
SỞ GD & ĐT HẢI PHÒNG
TRƯỜNG THPT LÊ QUÝ ĐÔN
ĐỀ THI GIỮA KÌ II NĂM HỌC 2020 - 2021
MÔN HÓA HỌC - KHỐI 10 KHTN
Thời gian làm bài : 45 Phút; (Đề có 32 câu)
(Đề có 4 trang)
Họ tên: .......................................................... Số báo danh: ............
PHẦN TRẮC NGHIỆM (7đ- 24’)
Câu 1: Axit nào sau đây có khả năng ăn mòn thủy tinh?
A. HF. B. HCl. C. HI. D. HBr.
Câu 2: Clorua vôi là một hóa chất phổ biến để tẩy uế, diệt trùng, tẩy trắng. Công thức của
Clorua vôi là:
A. CaCl2. B. CaO. C. CaOCl2. D. Ca(ClO3)2.
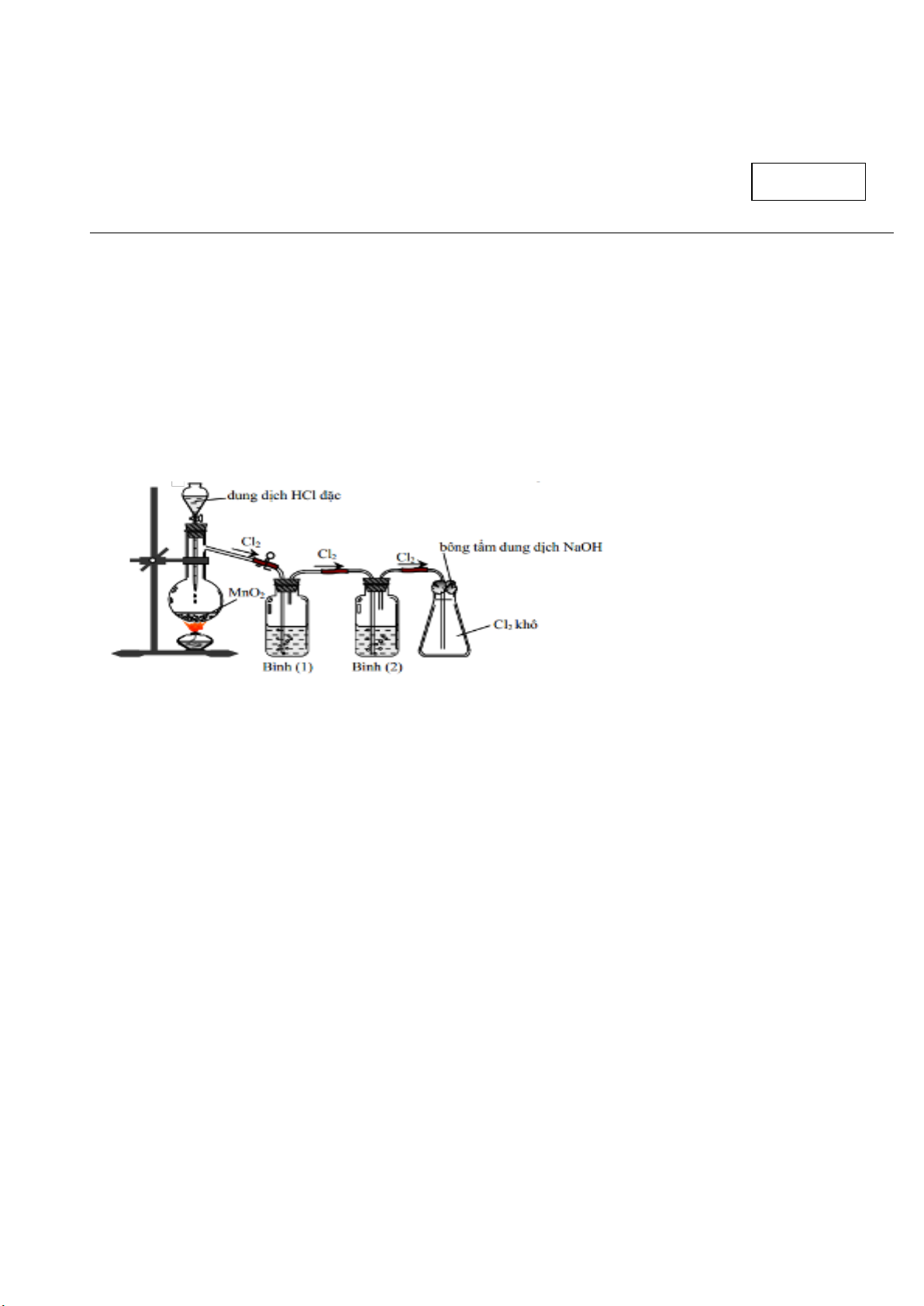
Câu 3: Hình vẽ dưới đây mô tả điều chế khi Cl2 trong phòng thí nghiệm:
Nhận định nào sau đây không đúng?
A. Bình 1 đựng dung dịch H2SO4 đặc, bình 2 đựng dung dịch NaCl.
B. Bình 2 chứa dung dịch H2SO4 (đặc) có vai trò là giữ hơi nước.
C. Có thể thay thế MnO2 bằng KMnO4 hoặc KClO3.
D. Bình 1 chứa dung dịch NaCl (bão hòa) có vai trò là giữ HCl.
Câu 4: Hòa tan một kim loại R hóa trị 2 vào dung dịch HCl, sau phản ứng thu được 7,6(g)
muối và thoát ra 1,792(l) khí ở đktc. Xác định kim loại R?
A. Mg. B. Zn. C. Fe.. D. Ca.
Câu 5: Nguyên nhân dẫn đến tính oxi hóa của nhóm halogen giảm dần theo chiều tăng của
điện tích hạt nhân là
A. do số electron lớp ngoài cùng giảm dần. B. do khối lượng phân tử tăng dần.
C. do số lớp electron giảm dần. D. do độ âm điện giảm dần.
Câu 6: Halogen tồn tại dạng lỏng ở điều kiện thường là
A. Cl2. B. Br2. C. I2. D. F2.
Câu 7: Cách điều chế Cl2 trong phòng thí nghiệm là
A. điện phân dung dịch NaCl có màng ngăn.
Mã đề 101

Mã đề 101 Trang 2/4
B. điện phân dung dịch NaCl không có màng ngăn.
C. cho KMnO4 tác dụng với dung dịch HCl đặc nóng.
D. điện phân nóng chảy NaCl.
Câu 8: Phản ứng nào sau đây Cl2 vừa thể hiện tính khử vừa thể hiện tính oxi hóa?
A. 3Cl2 + 2Fe
0
t
2FeCl3.
B. Cl2 + H2
as
2HCl.
C. Cl2 + 2NaOH
NaCl + NaClO + H2O.
D. 2NaCl+ H2O
đpdd
2NaOH + H2 + Cl2.
Câu 9: Hấp thụ hết V(l) khí HBr (đktc) vào H2O được 600ml dung dịch chứa nồng độ chất tan
là 0,3M. Giá trị của V là
A. 4,032. B. 4,48. C. 2,24. D. 2,016.
Câu 10: Tính chất hóa học của dung dịch HCl là
A. tính oxi hóa mạnh và tính khử rất yếu.
B. tính axit mạnh và tính khử yếu.
C. tính bazơ mạnh và tính khử yếu.
D. tính axit mạnh và tính oxi hóa rất mạnh.
Câu 11: Hóa chất để điều chế HCl trong phòng thí nghiệm là
A. khí H2 và khí Cl2.
B. khí Cl2 và dung dịch NaOH loãng.
C. tinh thể NaCl và dung dịch H2SO4 đậm đặc.
D. tinh thể NaCl và dung dịch H2SO4 loãng.
Câu 12: Kim loại Fe cháy trong khí Cl2 tạo ra khói màu nâu. Điều đó chứng tỏ sản phẩm tạo
thành là
A. FeCl3. B. Fe2Cl3. C. FeCl2. D. FeCl.
Câu 13: Nguyên nhân dẫn đến các halogen có tính chất hóa học đặc trưng là tính oxi hóa vì
A. phân tử luôn là chất khí hoặc chất lỏng nên chỉ có thể có tính oxi hóa.
B. nguyên tử có 7 electron lớp ngoài cùng nên dễ nhường 7 electron để trở thành cấu hình
electron của khí.
C. nguyên tử có 7 electron lớp ngoài cùng nên dễ nhận 1 electron để trở thành cấu hình
electron của khí hiếm.
D. phân tử luôn gồm 2 nguyên tử nên dễ nhận electron.
Câu 14: Cho dung dịch AgNO3 tới dư vào 30(g) dung dịch NaI 20%, sau phản ứng thu được
m(g) kết tủa. Giá trị của m là
A. 9,4. B. 14,1. C. 18,8. D. 8,61.
Câu 15: Đâu là tính chất vật lí của oxi?
A. chất rắn có màu tím thẫm, dễ thăng hoa tạo ra khí màu tím hồng độc, không tan trong nước.

Mã đề 101 Trang 3/4
B. chất khí không màu, không mùi, nặng hơn không khí, hóa lỏng ở -1830c, ít tan trong nước.
C. chất lỏng màu đỏ, bốc khói màu cam ở nhiệt độ phòng, gây bỏng nặng, tan trong nước.
D. chất khí màu xanh lam nhạt, có mùi hăng và khét, tan khá nhiều trong nước.
Câu 16: Chất nào là một dạng thù hình của O2?
A. O3. B. H2O. C. Cl2. D. H2.
Câu 17: Tính axit của HF < HCl < HBr < HI là do đi từ F đến I theo chiều tăng của điện tích
hạt nhân thì
A. độ bền liên kết HX giảm dần. B. độ âm điện giảm.
C. nguyên tử khối tăng. D. số electron tăng dần.
Câu 18: Cấu hình electron lớp ngoài cùng của các nguyên tử các nguyên tố nhóm VIA là
A. ns2np6. B. ns2np4. C. ns2np5. D. ns2np3.
Câu 19: Đâu không phải là tính chất vật lí của Clo ở điều kiện thường?
A. tan rất tốt trong nước tạo thành nước clo có màu vàng nhạt nhưng lại không tan trong các
dung môi hữu cơ.
B. là một chất vô cùng độc hại.
C. nặng hơn nhiều so với không khí.
D. là chất khí, có màu vàng lục, mùi vô cùng hắc.
Câu 20: O3 và O2 đều cùng phản ứng với chất nào sau?
A. H2. B. dung dịch KI. C. Ag. D. Cl2.
Câu 21: Nguyên tố halogen thuộc vị trí nào trong bảng tuần hoàn?
A. thuộc nhóm VIIA. B. thuộc nhóm IA.
C. thuộc chu kì 7. D. thuộc nhóm VIIB.
Câu 22: Trong tự nhiên, nguyên tố Clo tồn tại chủ yếu
A. chỉ trong hợp chất dưới dạng ion ClO
x
B. cả dạng đơn chất và hợp chất.
C. dưới dạng đơn chất. D. chỉ trong hợp chất dưới dạng ion Cl-.
Câu 23: Liên kết trong phân tử HCl là liên kết
A. cộng hóa trị có cực. B. ion.
C. phân tử D. cộng hóa trị không cực.
Câu 24: Khi cho Cl2 lần lượt tác dụng với H2(as); Fe (t0); NaBr (dung dịch); NaI (dung dịch).
Số phản ứng chứng minh được Cl2 có tính oxi hóa mạnh là
A. 4. B. 1. C. 2. D. 3.
Câu 25: Ứng dụng nào sau đây không phải là ứng dụng của ozon?
A. tiệt trùng nước sinh hoạt, loại bỏ kim loại nặng, loại bỏ dư lượng thuốc trừ sâu.
B. trong ngành công nghiệp chế biến, bảo quản thực phẩm, tẩy trắng giấy, vải sợi.
C. điều chế oxi trong phòng thí nghiệm.
D. xử lý ô nhiễm, làm sạch môi trường.


![Đề thi giữa học kì 2 môn Hóa học lớp 10 (tham khảo) - [Kèm đáp án chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250319/vangiang1602/135x160/4131742402167.jpg)



![Đề thi giữa học kì 2 Toán lớp 7 năm 2024-2025: [Kèm Đáp Án + Mới Nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250312/pdcduycuong/135x160/7791741767446.jpg)

![Đề thi giữa học kì 2 KHTN lớp 9 năm 2024-2025: [Kèm đáp án + chuẩn cấu trúc]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250307/lannhungdungduyen/135x160/3781741340921.jpg)























![Đề thi Tiếng Anh có đáp án [kèm lời giải chi tiết]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20250810/duykpmg/135x160/64731754886819.jpg)



