
M C L CỤ Ụ

I. QUÁ TRÌNH KEO TỤ
1. C s khoa h cơ ở ọ
1.1. Khái ni m và c chệ ơ ế
Hi n t ng các h t keo cùng lo i có th hút nhau t o thành nh ng t pệ ượ ạ ạ ể ạ ữ ậ
h p h t có kích th c và kh i l ng đ l n đ có th l ng xu ng do tr ngợ ạ ướ ố ượ ủ ớ ể ể ắ ố ọ
l c trong th i gian đ ng n đ c g i là hi n t ng keo t . Hi n t ng nàyự ờ ủ ắ ượ ọ ệ ượ ụ ệ ượ
x y ra khi th ả ế ζ đ c tri t tiêu.ượ ệ
Nguyên t c chung: ắĐ i v i h phân tán có di n tích b m t riêng l nố ớ ệ ệ ề ặ ớ
(b i trong không khí, bùn, phù sa trong n c...) các h t luôn có xu h ng coụ ướ ạ ướ
c m l i t o h t l n h n đ gi m năng l ng b m t (t ng t hi n t ngụ ạ ạ ạ ớ ơ ể ả ượ ề ặ ươ ự ệ ượ
gi t n c, gi t th y ngân luôn t vo tròn đ gi m di n tích b m t). Vọ ướ ọ ủ ự ể ả ệ ề ặ ề
nguyên t c do đ phân tán l n, di n tích b m t riêng l n, h t keo có xu thắ ộ ớ ệ ề ặ ớ ạ ế
hút nhau nh các l c b m t. M t khác do các h t keo cùng lo i luôn tíchờ ự ề ặ ặ ạ ạ
đi n cùng d u (đ c tr ng b i th ệ ấ ặ ư ở ế ζ) nên các h t keo luôn đ y nhau b i l cạ ẩ ở ự
đ y tĩnh đi n gi a các h t cùng d u theo đ nh lu t Culong, xu h ng này làmẩ ệ ữ ạ ấ ị ậ ướ
h t keo không th hút nhau đ t o h t l n h n và l ng xu ng nh tr ng l cạ ể ể ạ ạ ớ ơ ắ ố ờ ọ ự
nh nh ng h t không tích đi n. Nh v y th ư ữ ạ ệ ư ậ ế ζ càng l n (h t keo càng tíchớ ạ
đi n) thì h keo càng b n (khó k t t a). Trong tr ng h p lý t ng: n u thệ ệ ề ế ủ ườ ợ ưở ế ế
ζ = 0 thì h t keo bi n thành c u t o t đi n ph ng, h t s không khác gì cácạ ế ấ ạ ụ ệ ẳ ạ ẽ
h t không tích đi n nên d dàng hút nhau đ t o h t l n h n có th l ngạ ệ ễ ể ạ ạ ớ ơ ể ắ
đ c.ượ
M t cách khác làm các h t keo co c m thành bông c n l n d l ng làộ ạ ụ ặ ớ ễ ắ
dùng các tác nhân thích h p “khâu” chúng l i thành các h t l n h n đ l n,ợ ạ ạ ớ ơ ủ ớ
n ng đ l ng. Hi n t ng này đ c g i là hi n t ng t o bông đ c th cặ ể ắ ệ ượ ượ ọ ệ ượ ạ ượ ự
hi n nh nh ng phân t các ch t cao phân t tan trong n c và có ái l c t tệ ờ ữ ử ấ ử ướ ự ố
v i các h t keo ho c các h t c n nh . Khác v i keo t có tính thu n ngh ch,ớ ạ ặ ạ ặ ỏ ớ ụ ậ ị
các ch t có kh năng t o bông đ c g i là các ch t t o bông hay tr keo t ,ấ ả ạ ượ ọ ấ ạ ợ ụ
quá trình t o bông là b t thu n ngh ch.ạ ấ ậ ị

Các c ch chính c a quá trình keo t t o bông g m:ơ ế ủ ụ ạ ồ
1. Quá trình n n l p đi n tích kép, gi m th ζ nh ion trái d u: ế ớ ệ ả ế ờ ấ Phá tính
b n c a h keo (do l c đ y tĩnh đi n) b ng cách thu h p l p đi n kép t iề ủ ệ ự ẩ ệ ằ ẹ ớ ệ ớ
m c th zeta = 0, khi đó l c đ y tĩnh đi n h t – h t b ng không, t o đi uứ ế ự ẩ ệ ạ ạ ằ ạ ề
ki n cho các h t keo hút nhau b ng các l c b m t t o h t l n h n d k tệ ạ ằ ự ề ặ ạ ạ ớ ơ ễ ế
t a. Cách này có th th c hi n khi cho h t keo h p ph đ đi n tích trái d uủ ể ự ệ ạ ấ ụ ủ ệ ấ
đ trung hoà đi n tích h t keo. Đi n tích trái d u này th ng là các ion kimể ệ ạ ệ ấ ườ
lo i đa hoá tr .ạ ị
2. Quá trình h p ph ion trái d u trên b m t, trung hòa đi n tích t o raấ ụ ấ ề ặ ệ ạ
đi m đ ng đi n zeta = 0: ể ẳ ệ T o đi u ki n cho các h t keo va ch m v i cácạ ề ệ ạ ạ ớ
bông k t t a c a chính ch t keo t nh hi n t ng h p ế ủ ủ ấ ụ ờ ệ ượ ấ ph ụbám dính (hi uệ
ng quét).ứ
3. Quá trình keo h p ph cùng l ng trong quá trình l ng: ấ ụ ắ ắ Dùng nh ngữ
ch t cao phân t – tr keo t đ h p ph “khâu” các h t nh l i v i nhau t oấ ử ợ ụ ể ấ ụ ạ ỏ ạ ớ ạ
h t kích th c l n (g i là bông hay bông c n) d l ng.ạ ướ ớ ọ ặ ễ ắ
4. H p ph t o c u n i: các polymer vô c ho c h u c có th ion hóaấ ụ ạ ầ ố ơ ặ ữ ơ ể
nh c u trúc m ch dài chúng t ra các c u n i gi a các h t keo.ờ ấ ạ ạ ầ ố ữ ạ
Ta quan tâm ch y u đ n s keo t b ng ch t đi n ly, vì đi u đó có ýủ ế ế ự ụ ằ ấ ệ ề
nghĩa lý thuy t và th c t quan tr ng:ế ự ế ọ
a. Keo t keo ghét l u b ng ch t đi n ly.ụ ư ằ ấ ệ
Nguyên t cắ
Khi tăng n ng đ ho c hoá tr c a ion trong dung d ch, s làm gi mồ ộ ặ ị ủ ị ẽ ả
b dày l p đi n kép, làm gi m đi n th ζ c a h t. Khi th đi n đ ng gi mề ớ ệ ả ệ ế ủ ạ ế ệ ộ ả
đ n c c ti u ho c khi ζ →0 thì l c đ y c a h t gi m đ n c c ti u, l c hútế ự ể ặ ự ẩ ủ ạ ả ế ự ể ự
tr i tr n s keo t s x y ra. Các h t s sa l ng đ c thân, nh ng th ng k tộ ơ ự ụ ẽ ẩ ạ ẽ ắ ộ ư ườ ế
dính, t p h p l i và sa l ng.ậ ợ ạ ắ
Các quy t c keo t b ng ch t đi n ly.ắ ụ ằ ấ ệ
- Ion gây keo t có đi n tích ng c d u v i ion keo.ụ ệ ượ ấ ớ

- Ng ng keo t t l ngh ch v i hoá tr c a ion gây keo t .ưỡ ụ ỷ ệ ị ớ ị ủ ụ
Ng ng keo t (Cưỡ ụ n) c a ch t đi n ly đ i v i s keo t là n ng đ t iủ ấ ệ ố ớ ự ụ ồ ộ ố
thi u c a ch t đi n ly c n có trong h keo đ hi n t ng keo t b t đ uể ủ ấ ệ ầ ệ ể ệ ượ ụ ắ ầ
xu t hi n:ấ ệ
C =
C: nồng độ (mol/l, mmol/l) dung dịch điện ly
Vk và Vđ: các thể tích hệ keo và thể tích dung dịch điện ly
Đ i v i ion gây keo t cùng hoá tr , ion nào hydrat hoá càng m nhố ớ ụ ị ạ
(bán kính hydrat càng l n) c ng đ đi n tr ng c a nó càng nh , tác d ngớ ườ ộ ệ ườ ủ ỏ ụ
gây keo t c a nó càng kém. Đ i v i các ion kim lo i ki m, tác d ng gây keoụ ủ ố ớ ạ ề ụ
t c a chúng tăng d n nh sau: Liụ ủ ầ ư +, Na+, K+, Cs+ do bán kính hydrat c a ionủ
gi m d n theo d y đó.ả ầ ẫ
b. S keo t keo ghét l u b ng h n h p ch t đi n ly.ự ụ ư ằ ỗ ợ ấ ệ
V nguyên t c chung, thì s keo t đây cũng theo các quy t c trên,ề ắ ự ụ ở ắ
nh ng hi n t ng x y ra ph c t p h n. Ngoài tác d ng t ng h gi a hatư ệ ượ ẩ ứ ạ ơ ụ ươ ỗ ữ
keo và ion gây keo t còn có t ng tác gi a các ch t đi n ly v i nhau.ụ ươ ữ ấ ệ ớ
Đ i v i m t h keo xác đ nh, m i ch t đi n ly gây keo t có m tố ớ ộ ệ ị ỗ ấ ệ ụ ộ
ng ng keo t riêng bi t. N u dùng h n h p c a các ch t đi n ly gây keo tưỡ ụ ệ ế ỗ ợ ủ ấ ệ ụ
thì có 3 tr ng h p khác nhau v ng ng keo t t ng h p nh sau:ườ ợ ề ưỡ ụ ổ ợ ư
Tác d ng c ng tính c a các ion gây keo t .ụ ộ ủ ụ
Ng ng keo t t ng h p Cưỡ ụ ổ ợ n b ng t ng các ng ng keo t Cằ ổ ưỡ ụ i c a m iủ ỗ
ch t đi n ly v i t l đã s d ng trong t h p:ấ ệ ớ ỷ ệ ử ụ ổ ợ
Cn = C1 + C2 = C1 + C2 = …
C
1
và C
2
: ngưỡng tụ của chất điện ly 1 và 2 khi gây keo tụ riêng.
Tác d ng gi m kh nang gây keo t c a các ion.ụ ả ả ụ ủ
Ngu ng keo t t ng h p Cỡ ụ ổ ợ l n hon ngu ngớ ỡ keo t Cụi c a m i ch t di nủ ỗ ấ ệ
ly v i t l dã s d ng trong h n h p.ớ ỷ ệ ử ụ ỗ ợ
Cn
C1 + C2 ; Cn = C1 + C2 …
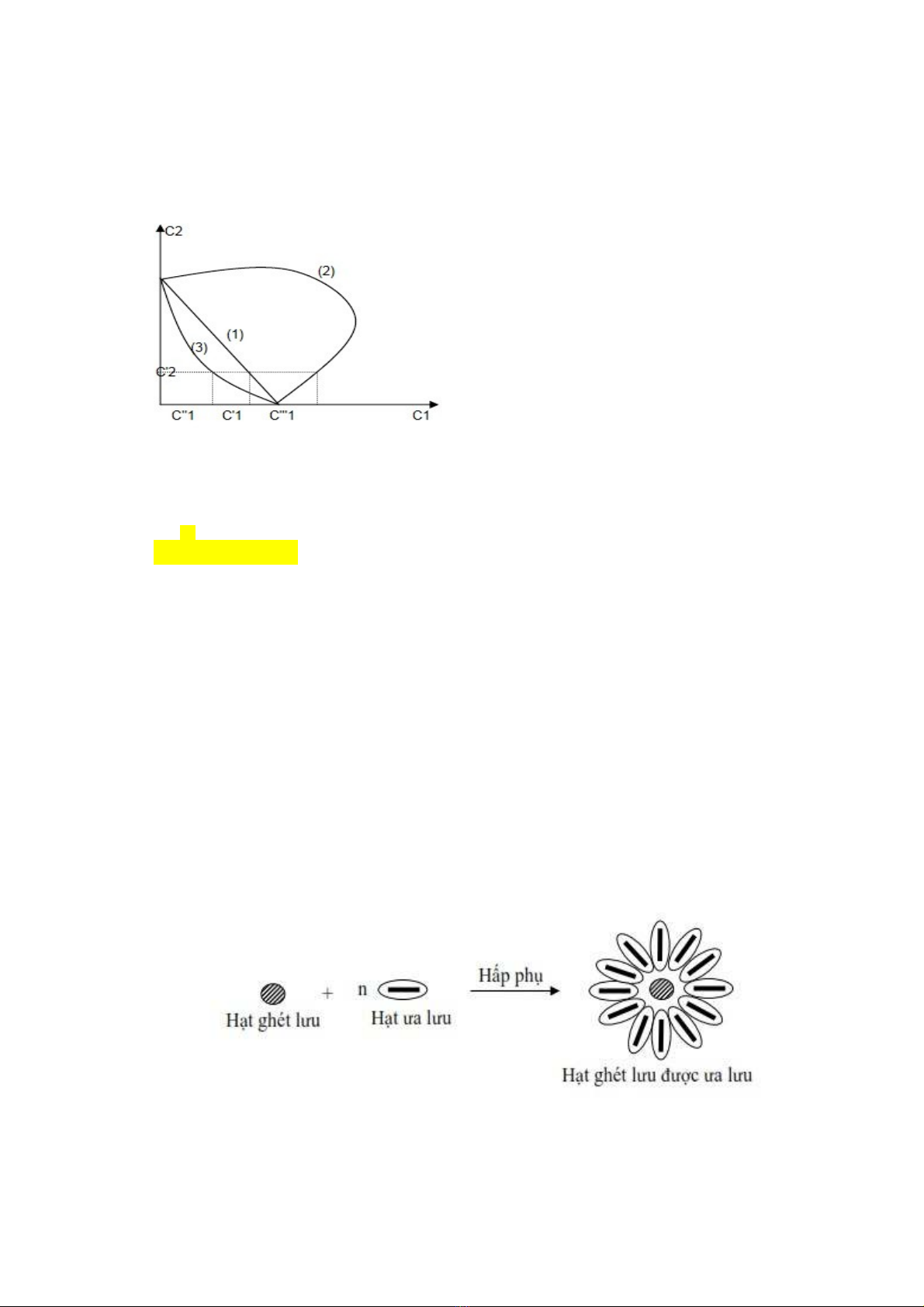
Tác d ng tăng c ng kh năng gây keo t c a các ch t đi n ly. ụ ườ ả ụ ủ ấ ệ
Ng ng keo t t ng h p Cn đây nh h n t ng các ng ng keo riêngưỡ ụ ổ ợ ở ỏ ơ ổ ưỡ
v i t l đã dùng trong t h p.ớ ỷ ệ ổ ợ
Ng ng keo t t ng h p Cn đ i v i 2 ch t đi n ly gây keo t c ng tínhưỡ ụ ổ ợ ố ớ ấ ệ ụ ộ
(1), đ i kháng (2) và tăng c ng (3).ố ườ
Cn
C1 + C2…
c. S keo t t ng h .ự ụ ươ ỗ
S keo t t ng h đây bao g m s keo t m t h keo b ng m t hự ụ ươ ỗ ở ồ ự ụ ộ ệ ằ ộ ệ
keo có đi n tích trái d u ho c m t h keo a l u ho c m t dung d ch ch tệ ấ ặ ộ ệ ư ư ặ ộ ị ấ
bán keo.
Gi a keo a l u và keo ghét l u (H keo ghét l u kém b n. H keo aữ ư ư ư ệ ư ề ệ ư
l u b n)ư ề
C ch : N u cho m t l ng keo a l u không quá ít vào keo ghét l u thìơ ế ế ộ ượ ư ư ư
tính b n c a keo ghét l u đ c tăng c ng:ề ủ ư ượ ườ
Trái l i khi l ng keo a l u (cao phân t ) quá ít thì nó l i thúc đ y quáạ ượ ư ư ử ạ ẩ
trình keo t , nghĩa là làm cho keo ghét l u d đông t h n, đó là s keo tụ ư ễ ụ ơ ự ụ


























