
ASEN VÀ TÁC Đ NG C A Ộ Ủ
NÓ Đ N CON NG IẾ ƯỜ
Sinh viên: T Th Mùaạ ị
L p 39: BQCBNSớ
Khoa Nông H cọ
N i Dung Chínhộ
1. Đ c đi m c a kim lo i n ng Asenặ ể ủ ạ ặ
2. Tính ch t lý hóa h c c a Asenấ ọ ủ
3. M t s h p ch t c a Asenộ ố ợ ấ ủ
4. Tiêu chu n v Asenẩ ề
5. nh h ng c a Asen đ i v i s c kh e con Ả ưở ủ ố ớ ứ ỏ
ng iườ
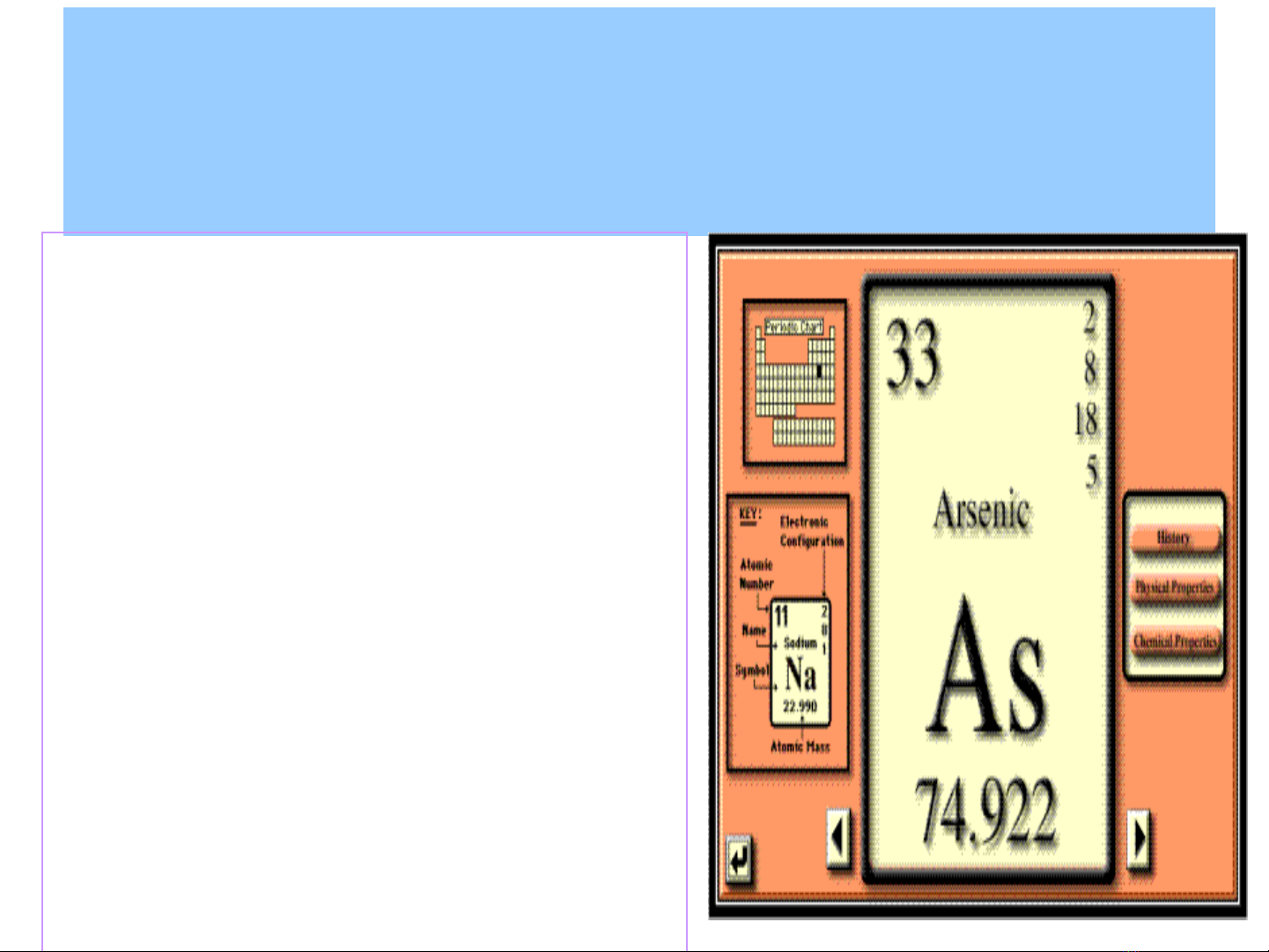
Đ c đi m c a kim lo i n ng Asenặ ể ủ ạ ặ
Trong t nhiên asen có ự
trong nhi u lo i khoáng v t ề ạ ậ
nh Realgar As4S4, ư
Orpoment As2S3,
Arsenolite As2O3,
Arsenopyrite FeAsS (t i ớ
368 d ng)..ạ
Trong n c asen th ng ướ ườ ở
d ng arsenic ho c arsenate ạ ặ
(AsO33-, AsO43-).
Các h p ch t Asen methyl ợ ấ
có trong môi tr ng do ườ
chuy n hóa sinh h c. ể ọ













![Đề thi kết thúc học phần Nguyên lí Hóa học 2 [mới nhất]](https://cdn.tailieu.vn/images/document/thumbnail/2025/20251014/anhinhduyet000/135x160/69761760428591.jpg)













